ნახშირბადი სექციების სია ისტორია | ფიზიკური თვისებები | ნახშირბადის ალოტროპიული მოდიფიკაცია | ბუნებაში არსებობა | ქიმიური თვისებები | გამოყენება | ტოქსიკური მოქმედება | იხილეთ აგრეთვე | ლიტერატურა | წყაროები | სქოლიო | სანავიგაციო მენიუბუნებრივი ენერგომატარებლების და ნახშირბადული მასალების ქიმიანახშირბადი Webelements-ზენახშირბადი ქიმიური ელემენტების პოპულარულ ბიბლიოთეკაშიინფორმაცია ნახშირბადზეალექსეი სლადკოვის ნახშირბადისლადკოვი კარბინი — ნახშირბადის მესამე ალოტროპილი ფორმა: მონოგრაფიაქიმიკოსებმა გააბრტყელეს ნახშირბადირ
ნახშირბადის ნაერთებიქიმიური ელემენტებიარალითონებინახშირბადი
პერიოდული სისტემისხის ნახშირისალოტროპიული მოდიფიკაციაალმასიგრაფიტიანტუან ლავუაზიეს1780ლათ.ქიმიური კავშირებიალმასიკარბინიგრაფინიგრაფიტიფულერენიალმასისაგრაფიტისალმასისგრაფიტშიგრაფიტიალმასისსიმკვრივეგრაფიტისსიმკვრივეალმასიელექტრულ დენსასითბოსგრაფიტსლითონურიელექტრული დენისასითბოსალმასიგრაფიტიქაღალდზეალმასიგრაფიტიტემპერატურაზეგრაფიტიალმასადატმოსფერული წნევისალმასიგრაფიტისკარბინიჰექსაგონალურიგრაფიტადფულერენიგრაფინი1950ატომური ელექტროსადგურისწყალბადის ბომბისდაშლაზერადიონახშირბადული დატირებისმეოთხედული გეოლოგიაშიარქეოლოგიაშიელექტრონულ ორბიტალსმისი ელექტრონული ორბიტალების ჰიბრიდიზაციისალმასიგრაფიტიმეტასტაბილურნი არიანსუბლიმირდებაპასიმკვრივეკრისტალური მესერიანივიურციტისლონდსდეილიტისივრცებრივი ჯგუფისიმკვრივემეტეორიტებში«ნანოალმასი»ასაფეთქებელი ნივთიერებებისდეტონაციისჟანგბადის ბალანსითტროტილისაჰექსოგენისტორფინახშირიტუნგუსკის მეტეორიტისსინგონიისკარბინიჩაოიტისაცეტილენისნახევარგამტარისფოტოელემენტებშიკლასტერულიფულერენიგრაფენებისნანომილაკებიასტრალენიქვანახშირის კოქსიმურაქვანახშირიტექნახშირბადიმურიაქტიური ნახშირიკარბონატებისკირქვებიდოლომიტებიანტრაციტიმურა ნახშირისქვანახშირისნავთობისსაწვავი ბუნებრივი აირისმეთანიტორფებისბიტუმისდედამიწის ატმოსფეროშიჰიდროსფეროშინახშირორჟანგისნახშირორჟანგიწიაღისეული საწვავისტროფოსფეროდანბიოსფეროდანგეოსფეროშიორთქლისმაგვარაზოტთანწყალბადთანმზისნახშირწყალბადებიორგანული ქიმიაიონიზაციის ენერგიამეთანიტეტრაფტორმეთანინახშირბადის მონოქსიდინახშირბადის დიოქსიდიწყალბადთანფთორთანნახშირორჟანგინახშირბადის დიოქსიდინახშირმჟავასკარბონატებსკალციუმის კარბონატიცარციმარმარილოკალციტიკირქვამაგნიუმის კარბონატიდოლომიტიჰალოგენებთანტუტე ლითონებთანკლატრატებსელექტროდებსციანისინილის მჟავასგოგირდნახშირბადიბორთანსილიციუმთანკარბიდებსმეტალურგიულ მრეწველობაშიპოლიმერული ჯაჭვებიორგანული ქიმიანახშირწყალბადებიცილებიცხიმებიგრაფიტიალმასიაბრაზიული მასალაბრილიანტიძვირფასი ქვაოქრომჭედლობაშითბოგამტარობისნახევარგამტარულ თექნიკაშიცენტრალური პროცესორისნახშირმჟავასჰეტეროციკლებიპოლიმერებიკარბოლენიგრაფიტინახშირბადის იზოტოპებირადიონახშირბადული ანალიზიფოტოსინთეზისქვანახშირინახშირწყალბადებინავთობიბუნებრივი აირიენერგიისთბოელექტროსადგურებშიზედა სასუნთქი გზებისფიტვებისბრონქიტიდნმβ-ნაწილაკებთან
(function()var node=document.getElementById("mw-dismissablenotice-anonplace");if(node)node.outerHTML="u003Cdiv class="mw-dismissable-notice"u003Eu003Cdiv class="mw-dismissable-notice-close"u003E[u003Ca tabindex="0" role="button"u003Eდამალვაu003C/au003E]u003C/divu003Eu003Cdiv class="mw-dismissable-notice-body"u003Eu003Cdiv id="localNotice" lang="ka" dir="ltr"u003Eu003Cdiv class="layout plainlinks" align="center"u003Eდაუკავშირდით ქართულ ვიკიპედიას u003Ca href="https://www.facebook.com/georgianwikipedia" rel="nofollow"u003Eu003Cimg alt="Facebook icon.svg" src="//upload.wikimedia.org/wikipedia/commons/thumb/1/1b/Facebook_icon.svg/14px-Facebook_icon.svg.png" decoding="async" width="14" height="14" srcset="//upload.wikimedia.org/wikipedia/commons/thumb/1/1b/Facebook_icon.svg/21px-Facebook_icon.svg.png 1.5x, //upload.wikimedia.org/wikipedia/commons/thumb/1/1b/Facebook_icon.svg/28px-Facebook_icon.svg.png 2x" data-file-width="256" data-file-height="256" /u003Eu003C/au003E u003Cbu003Eu003Ca rel="nofollow" class="external text" href="https://www.facebook.com/georgianwikipedia"u003EFacebooku003C/au003Eu003C/bu003E-ის ოფიციალურ გვერდზე!nu003Cpu003Eu003Cbr /u003Enu003C/pu003Enu003C/divu003Eu003C/divu003Eu003C/divu003Eu003C/divu003E";());
ნახშირბადი
Jump to navigation
Jump to search
ნახშირბადი / Carboneum (С)  | |
|---|---|
| ელემენტის რიგითი ნომერი | 6 |
| მარტივი ნივთიერების ვიზუალური აღწერა |  !-- Appearance--> !-- Appearance--> |
| ატომის თვისებები | |
ატომური მასა (მოლური მასა) | 12,011 (იზოტოპების ბუნებრივი ნარევი) მ. ა. ე. (გ/მოლი) |
| ატომის რადიუსი | 91 პმ |
იონიზაციის ენერგია (პირველი ელექტრონი) | 1: 1086.5 (11,25) 2: 2352.6 3: 4620.5 კჯ/მოლი (ევ) |
| ელექტრონული კონფიგურაცია | [He] 2s2 2p2 |
| ქიმიური თვისებები | |
| კოვალენტური რადიუსი | 77(sp³), 73(sp²), 69(sp) პმ |
| იონური რადიუსი | 16 (+4e) 260 (-4e) პმ |
ელექტროუარყოფითობა (პოლინგის თანახმად) | 2.55 |
| ელექტროდული პოტენციალი | |
| ჟანგვის ხარისხი | 4, 3, 2, 1, 0, -1, -2, -3, -4 |
| მარტივი ნივთიერებების თერმოდინამიკური თვისებები | |
| ნივთიერების სიმკვრივე | ამორფული: 1.8–2.1, გრაფიტი: 2.267, ალმასი: 3.515 გ/სმ³ |
| ხვედრითი თბოტევადობა | 8,54 ჯ/(კ·მოლი) |
| თბოგამტარობა | 1,59 ვტ/(მ·კ) |
| დნობის ტემპერატურა | 3 820 °C, კ |
| დნობის სითბო | 117 (გრაფიტი) კჯ/მოლი |
| დუღილის ტემპერატურა | 5 100 კ |
| აორთქლების სითბო | კჯ/მოლი |
| მოლური მოცულობა | 5,3 სმ³/მოლი |
| მარტივი ნივთიერების კრისტალური მესერი | |
| მესრის სტრუქტურა | ჰეგსაგონალური (გრაფიტი), კუბური (ალმასი) |
| მესრის პერიოდი | Å |
| შეფარდება | 2,73 (გრაფიტი) |
| დებაის ტემპერატურა | 1860 კ |
6C 12,011 [He] 2s2 2p2 ნახშირბადი |

ნახშირბადის ატომის სქემა
ნახშირბადი (ქიმიური სიმბოლო — C) მენდელეევის პერიოდული სისტემის 2-ე პერიოდის მე-4 ჯგუფის მთავარი ქვეჯგუფის ქიმიური ელემენტი, მისი რიგითი ნომერის 6, იზოტოპების ბუნებრივი ნარევის ატომური მასა არის 12,0107 გ/მოლი.
სექციების სია
1 ისტორია
1.1 დასახელების წარმომავლობა
2 ფიზიკური თვისებები
2.1 ნახშირბადის იზოტოპები
3 ნახშირბადის ალოტროპიული მოდიფიკაცია
3.1 გრაფიტი და ალმასი
3.2 ულტრადისპერსიული ალმასები (ნანოალმასი)
3.3 კარბინი
3.4 ფულერენი და ნახშირბადიანი ნანომილაკები
3.5 ამორფული ნახშირბადი
3.6 გრაფენი
4 ბუნებაში არსებობა
5 ქიმიური თვისებები
5.1 არაორგანული შენაერთები
5.2 ორგანული ნაერთები
6 გამოყენება
7 ტოქსიკური მოქმედება
8 იხილეთ აგრეთვე
9 ლიტერატურა
10 წყაროები
11 სქოლიო
ისტორია |
ნახშირბადი ხის ნახშირის სახით გამოიყენებოდა ძველი დროიდან ლითონების გამოსადნობად. ძველთაგანვე ცნობილია ნახშირბადის ალოტროპიული მოდიფიკაცია — ალმასი და გრაფიტი. ნახშირბადის ელემენტალური ბუნება დადგენილია ანტუან ლავუაზიეს მიერ 1780-იან წლებში.
დასახელების წარმომავლობა |
საერთაშორისო სახელწოდება მოდის ლათ. carbō «ნახშირი».
ფიზიკური თვისებები |
ნახშირბადი არსებობს მრავალი ალოტროპული მოდიფიკაციას სახით სხვადასხვა ფიზიკური თვისებებით. მოდიფიკაციის სხვადასხვაობა განპიროვნებულია ნახშირბადის უნარით წარმოქმნას სხვადასხვა ტიპის ქიმიური კავშირები. ცნობილია ნახშირბადის ხუთი ალოტრპული მოდიფიკაცია - ალმასი, კარბინი, გრაფინი, გრაფიტი და ფულერენი. ალმასისა და გრაფიტის კრისტალური სტრუქტურა ატომურია, მაგრამ ისინი ერთმანეთისაგან განსხვავდებიან მესერში ატომების განლაგებით. ალმასის კრისტალურ მესერში ნახშირბადის თითოეული ატომი სხვა ატომებთან ახორციელებს ოთხ კოვალენტურ ბმას ტეტრაედრის წვეროების მიმართულებით (ბმის კუთხე - 109,28o, ბმის სიგრძე - 0,154 ნმ). ამით აიხსნება ალმასის დიდი სიგრძე. გრაფიტში ნახშირბადის ატომები განლაგებულია წესიერი ექსკუთხედის წვეროებში, რომლებიც შრეებს ქმნიან. მეზობელ პარალელურ შრეებს შორის მანძილი გაცილებით მეტია (0,335 ნმ), ვიდრე ერთსა და იმავე შრეში მეზობელ ატომებს შორის (0,142 ნმ). ეს იწვევს შრეებს შორის კავშირის შესუსტებას, რის გამო უბრალო მექანიკური ზემოქმედებითაც კი გრაფიტი ადვილად იშლება ფენებად, რომლებიც თავისთავად ძალიან მტკიცეა. ალმასის სიმკვრივე - 3510 კგ/მ3 , გრაფიტის სიმკვრივე - 2250 კგ/მ³, tლღ 3570oC, tდუღ 4200oC. ალმასი ელექტრულ დენსა და სითბოს არ ატარებს. გრაფიტს ახასიათებს ლითონური ბზინვა; ელექტრული დენისა და სითბოს კარგი გამტარია. ალმასი ყველა ბუნებრიც მივთიერებაზე მაგარია, გრაფიტი კი ქაღალდზე სუსტი გახახნუებითაც კი იშლება და ტოვებს კვალს.
ალმასი და გრაფიტი მაღალ ტემპერატურაზე ურთიერთ გარდაიქმნება. გრაფიტი ალმასად გარდაიქმნება 2000oC, 100 000 ატმოსფერული წნევის პირობებში, ხოლო ალმასი გრაფიტის სახეს იღებს უჰაეროდ გახურების დროს - 1500oC.
ნახშირბადის მესამე მოდიფიკაცია - კარბინი ჰექსაგონალური სტრუქტურის შავი ფერის ფხვნილია. პირველად მიიღეს სინთეზის გზით, შემდეგ აღმოაჩინეს ბუნებაშიც. გახურების დროს (2800oC) გარდაიქმნება გრაფიტად.
უკანასკნელ პერიოდში აღმოაჩინეს ნახშირბადის კიდევ ორი მოდიფიკაცია - ფულერენი და გრაფინი.
ნახშირბადის იზოტოპები |
ბუნებრივი ნახშირბადი შედგება ორი სტაბილური იზოტოპისაგან — 12С (98,93 %) და 13С (1,07 %) და ერთი რადიოაქტიური იზოტოპისაგან 14С (β-გამოსხივება, Т½= 5700 წ.), თავმოყრილია ატმოსფეროში და დედამიწის ქერქის ზედაპირზე. ის ყოველთვის იქმება სტრატოსფეროს ქვედა ფენებში კოსმიური გამოსხივების ნეიტრონების ზემოქმედების შედეგად აზოტის ბირთვებზე, შემდეგი რეაქციით: 14N (n, p) 14C, ასევე, 1950 წ., როგორც ატომური ელექტროსადგურის მუშაობის ტექნოგენური პროდუქტი და წყალბადის ბომბის გამოცდის შედეგი.
წარმოქმნაზე და დაშლაზე 14С დაფუძნებულია რადიონახშირბადული დატირების მეთოდი, ფართოდ გამოიყენება მეოთხედული გეოლოგიაში და არქეოლოგიაში.
ნახშირბადის ალოტროპიული მოდიფიკაცია |
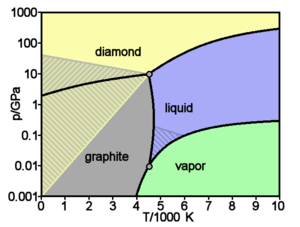
ნახშირბადის გამარტივებული ფაზური დიაგრამა, დაშტრიხული ზონა, სადაც ალოტროპიული მოდიფიკაციებს შეუძლიათ მეტასტაბილურები. (diamond — ალმასი, graphite — გრაფიტი, liquid — სითხე, vapor — აირი)
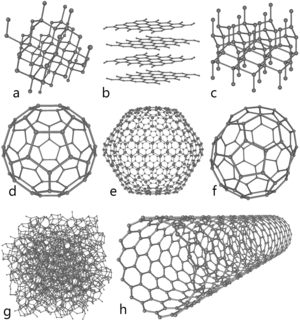
ნახშირბადის მოდიფიკაციების აღნაგობია სქემები
a: ალმასი, b: გრაფიტი, c: ლონსდეილიტი
d: ფულერენი — ბუკიბოლი C60, e: ფულერენი C540, f: ფულერენი C70
g: ამორფული ნახშირბადი, h: ნახშირბადის ნანომილაკი
- გრაფიტი
- ალმასი
- ცარბინი
- ლონსდეილიტი
- ფულერენი
- ნახშირბადის ნანომილაკები
- გრაფენი
- ამორფული ნახშირბადი
- ნახშირი
- ტექნახშირბადი
- მური
ნახშირბადის ატომის ელექტრონულ ორბიტალს შეიძლება ჰქონდეს სხვადასხვანაირი გეომეტრია, მისი ელექტრონული ორბიტალების ჰიბრიდიზაციის მიხედვით. არსებობს ნახშირბადის ატომის სამი ძირითადი გეომეტრია.
- ტეტრაედრული, წარმოიქმნება ერთი s- და სამი p- ელექტრონების შერევით (sp3-ჰიბრიდიზაცია). ნახშირბადის ატომი მდებარეობა ტეტრაედრის ცენტრში, შეკავშირებულია ოთხი ეკვივალენტური σ-კავშირით ნახშირბადის ატომთან ან სხათი ტეტრაედრის წვერთან. ნახშირბადის ატომის ასეთ გეომეტრიას შეესაბამება ნახშირბადის ალოტროპიული მოდიფიკაცია ალმასი და ლონსდეილიტი. ასეთი ჰიბრიდიზაციას ფლობს ნახშირბადი, მაგალითად, მეთანში და სხვა ნახშირწყალბადებში.
- ტრიგონალური, წარმოიქმნება ერთი s- და ორი p-ელექტრონული ორბიტალების შერევით (sp2-ჰიბრიდიზაცია). ნახშირბადის ატომს აქვს სამი თანაბარფასოვანი σ-კავშირი, რომლებიც განლაგებულნი არიან ერთ სიბრტყეზე 120° კუთხის დახრით ერთმანეთთან. ჰიბრიდიზაციაში არ მონაწილეობს p- ორბიტალი, რომელიც მდებარეობს σ-კავშირის სიბრტყის პერპენდიკულარულად, გამოიყენება π-კავშირის წარმოსაქმნელად სხვა ატომებთან. ნახშირბადის ასეთი გეომეტრია დამახასიათებელია გრაფიტისათვის, ფენილისათვის და სხვა.
- დიგონალური, წარმოიქმნება ერთი s- და ერთი p-ელექტრინის შერევით (sp-ჰიბრიდიზაცია). ამასთან ორი ელექტრონის ორბ. გაჭიმულია ერთი მიმართულებით და აქვს არასიმეტრიული ჰანტელის სახე. სხვა ორი р-ელექტრონი იძლევა π-კავშირს. ასეთი გეომეტრიის ატომის ნახშირბადი წარმოქმნის განსხვავებულ ალოტროპიულ მოდიფიკაციას — კარბინს.
2010 წ. ნოტინგემის უნივერსიტეტის თანამშრომლებმა სტივენ ლიდლმა და კოლეგებმა მიიღეს ნაერთი (მონომერული დილიტიო მეტანდი), სადაც ნახშირბადის ატომის ოთხი კავშირი მდებარეობენ ერთ სიბრტყეზე[1]. ადრე "ბრტყელი ნახშირბადის" შესაძლებლობა იწინასწარმეტყველა პაულ ფონ შლეიერის მიერ H2CLi2displaystyle H_2CLi_2, მაგრამ ის არ იქნა სინთეზირებული.
გრაფიტი და ალმასი |
ნახშირბადის ძირითადი და კარგად შესწავლილი ალოტროპიული მოდიფიკაციებია - ალმასი და გრაფიტი. ნორმალურ პირობებში თერმოდინამიკულად მდგრადია მხოლოდ გრაფიტი, ხოლო ალმასს და ნახშირბადის სხვა ფორმებს მეტასტაბილურნი არიან. ატმოსფერული წნევის და 1200 K მაღალი ტემპერატურისას ალმასი გადადის გრაფიტში, 2100 K ზევით კი გარდაქმნა ხდება მომენტალურად. ΔН0 გადასვლა — 1,898 კჯლ/მოლი. ნორმალური წნევისა და 3780 K ტემპერატურისას ნახშირბადი სუბლიმირდება. თხევადი ნახშირბადი არსებობს მხოლოდ გარკვეული გარე წნევის დროს. სამმაგი წერტილები: გრაფიტი-სითხე-ორთქლი Т = 4130 K, р = 10,7 მპა. გრაფიტის პირდაპირი გადასვლა ალმასში მიმდინარეობს 3000 K ტემპერატურისა და 11—12 გპა - წნევისას.
60 გ პა-ზე მეტი წნევისას სავარაუდოა უფრო მკვრივი, მჭიდრო მოდიფიკაციის წარმოქმნა С III (სიმკვრივე 15—20 %-ით უფრო მაღალია ვიდრე ალმასის), რომელსაც გააჩნია ლითონური გამტარობა. მაღალი წნევებისას და შედარებით დაბალი ტემპერატურებისას (მიახლ. 1200 K) მაღალორიენტირებული გრაფიტიდან წარმოიქმნება ნახშირბადის ჰექსაგონალური კრისტალური მესერიანი მოდიფიკაცია, ვიურციტის ტიპის — ლონდსდეილიტი (а = 0,252 ნმ, с = 0,412 ნმ, სივრცებრივი ჯგუფი Р63/mmc), სიმკვრივე 3,51 გ/სმ³, ანუ ისეთივე, როგორც ალმასი. ლონსდეილიტი ნაპოვნია ასევე მეტეორიტებში.
ულტრადისპერსიული ალმასები (ნანოალმასი) |
1980 წ. სსრკ-ში იქნა აღმოჩენილი ის, რომ ნახშირბადშემცველი მასალების დინამიკური დატვირთვის პირობებში შესაძლებელი წარმოიქმნეს ალმასის მსგავსი სტრუქტურები, რომლებმაც მიიღო ულტრადისპერსიული ალმასის სახელწოდება (უდა). თანამედროვე დროს ხშირად იხმარება ტერმინი «ნანოალმასი». ასეთი მასალებში ნაწილაკების ზომები შეადგენს ნანომეტრის ერთეულებს. უდა-ს წარმოქმნის პირობები შეიძლება რეალიზებულ იქნას ასაფეთქებელი ნივთიერებების დეტონაციის დროს მნიშვნელოვანი უარყოფითი ჟანგბადის ბალანსით, ტროტილისა და ჰექსოგენის ნარევის მაგალითზე. ასეთი პირობები შეიძლება რეალიზებულ იქნას ციური სხეულების დედამიწასთან შეჯახების დროს ნახშირბადშემცველი მასალების (ორგანიკა ტორფი, ნახშირი და სხვა) თანხლებით. ასე რომ ტუნგუსკის მეტეორიტის ვარდნის ზონაში ტყიან საგებელში აღმოჩენილ იქნა - უდა.
კარბინი |
ნახშირბადის ჰექსაგონალური სინგონიის კრისტალურ მოდიფიკაციას მოლეკულების ჯაჭვური აღნაგობით ეწოდება კარბინი. ჯაჭვებს აქვს ან პოლიენური (—C≡C—), ან პოლიკუმულენური (=C=C=) აღნაგობა. ცნობილია კარბინის რამდენიმე ფორმა, რომლებიც განსხვავდებიან ელემენტარული უჯრედში ატომების რაოდენობით, უჯრედების ზომები და სიმკვრივე (2,68—3,30 გ/სმ³). ბუნებაში კარბინი გვხვდება მინერალ ჩაოიტის სახით (თეთრი ძარღვები და ჩანართები გრაფიტში) და მიღებულია ხელოვნურადაც - აცეტილენის მჟანგავი დეჰიდროპოლიკონდენსაციით, გრაფიტზე ლაზერული დასხივებით, ნახშირწყალბადებში ან CCl4 დაბალტემპერატურული პლაზმაში.
კარბინი წარმოადგენს მწვრილკრისტალური შავი ფერის ფხვნილს (სიმკვრივე 1,9-2 გ/სმ³), გააჩნია ნახევარგამტარების თვისებები. მიღებულია ხელოვნურად ნახშირბადის გრძელი ატომების ჯაჭვებისაგან, განლაგებული არიან პარალელურად ერთმანეთთან.
კარბინი — ნახშირბადის სიგძივი პოლიმერია. კარბინის მოლეკულაში ნახშირბადის ატომები შეერთებულია ჯაჭვად რიგრიგობით ან სამმაგი და ერთმაგი კავშირით (პოლიენური აღნაგობა), ან მუდმივი ორმაგი კავშირებით (პოლიკუმულებური აღნაგობა). ეს ნივთიერება პირველად მიგებული იქნა საბჭოთა ქიმიკოსების ვ. ვ. კორშაკის, ა. მ. სლადკოვის, ვ. ი. კასატოჩკინის და ი. პ. კუდრიავცევის მიერ 60-წლებში. ელემენტოორგანული ნაერთების ინსტიტუტში[2]. კარბინს ახასიათებს ნახევარგამტარის თვისებები, ამასთან სინათლის ზემოქმედებით მისი გამტარობა ძლიერ იზრდება. ამ თვისებაზეა დაფუძნებული მისი პირველი პრაქტიკული გამოყენება - ფოტოელემენტებში.
ფულერენი და ნახშირბადიანი ნანომილაკები |
ნახშირბადი ცნობილია ასევე კლასტერული ნაწილაკების სახით С60, С70, C80, C90, C100 და მსგავსი (ფულერენი), ასევე გრაფენების, ნანომილაკები და რთული სტრუქტურებიანი — ასტრალენი.
ამორფული ნახშირბადი |
ამორფული ნახშირბადის აღნაგობის საფუძვლია მონოკრისტალური (ყოველთვის შეიცავს მინარევებს) გრაფიტი. ეს არის ქვანახშირის კოქსი, მურა და ქვანახშირი, ტექნახშირბადი, მური, აქტიური ნახშირი.
გრაფენი |
გრაფენი (англ. graphene) — ნახშირბადის ორგანზომილიანი ალოტროპიულ მოდიფიკაციას წარმოადგენს, რომელიც წარმოიქმნება ერთი ატომის სისქის ფენით, ნაერთი sp² კავშირის მეშვეობით, ჰექსაგონალური ორგანზომილებიანი კრისტალური მესერით.
ბუნებაში არსებობა |
ნახშირბადის შემცველობა დედამიწის ქერქში მასის 0,1 %-ია. თავისუფალი ნახშირბადი ბუნებაში ალმასისა და გრაფიტის ასხით გვხვდება. ნახშირბადის ძირითადი მასა ბუნებრივი კარბონატების (კირქვები და დოლომიტები), საწვავი წიაღისეულის - ანტრაციტი (94—97 % С), მურა ნახშირის (64—80 % С), ქვანახშირის (76—95 % С), საწვავი შრეების (56—78 % С), ნავთობის (82—87 % С), საწვავი ბუნებრივი აირის (99 %-მდე მეთანი), ტორფების (53—56 % С), ასევე ბიტუმის და სხვა სახით გვხვდება. ნახშირბადი დედამიწის ატმოსფეროში და ჰიდროსფეროში არსებობს ნახშირორჟანგის სახით СО2, ჰაერში მასის 0,046 % СО2, მდინარეების, ზღვებისა და ოკეანეების წყლებში ~60 -ჯერ მეტია. ნახშირბადი შედის მცენარეებისა და ვხოველების შემადგენლობაში(~18 %).
ადამიანის ორგანიზმში ნახშირბადი ხვდება საკვებთან ერთად (ნორმაა მიახლოებით 300 გ დღეღამეში). ნახშირბადის საერთო შემცველობა ადამიანის ორგანიზმში აღწევს მიახლოებით 21 % (15 კგ - 70 კგ სხეულის წონაზე). ნახშირბადი შეადგენს კუნთების მასის 2/3 ნაწილს დაძვლების მასის 1/3 ნაწილს. ორგანიზმიდან გამოდის უპირატესად ჰაერის ამოსუნთქვასთან ერთად (ნახშირორჟანგი) და შარდთან ერთად.
ნახშირბადის მიმოქცევა ბუნებაში ჩართულია ბიოლოგიურ ციკლში, СО2-ის გამოყოფა ატმოსფეროში წიაღისეული საწვავის წვის დროს, ვულკანური აირებიდან, ცხელი მინერალური წყაროებიდან, ოკეანის წყლების ზედა ფენებიდან და სხვა. ბიოლოგიური ციკლი შემდეგში მდგონარეობს, ნახშირბადიი СО2 სახით ტროფოსფეროდან შთაინთქმება მცენარეების მიერ. შემდეგ ბიოსფეროდან ხელახლა ბრუნდება გეოსფეროში: მცენარეებთან ერთად ნახშირბადი ხვდება ცხოველებისა და ადამიანის ორგანიზმში, შემდეგ კი ცხოველებისა და მცენარეების ლპობის შედეგად - ნიადაგში და СО2 სახით — ატმოსფეროში.
ორთქლისმაგვარ მდგომარეობაში და აზოტთან და წყალბადთან ნაერთების სახით ნახშირბადი აღმოჩენილია მზის ატმოსფეროში, პლანეტებზე, ქვის და რკინის მეტეორიტებზე.
ნახშირბადის უმეტესი შენაერთი, და უპირველყოვლისა ნახშირწყალბადები, ხასიათდებიან გამოკვეთილი კოვალენტური კავშირებით. ჩვეულებრივი, ორმაგი და სამმაგი ატომების კავშირების სიმტკიცე ერთმანეთთან, მდგრადი ჯაჭვების წარმოქმნის შესაძლებლობები და ატომების ციკლი განაპირობებს ნახშირბადშემცველი ნაერთების უდიდესი რაოდენობის არსებობას, რომელსაც შეისწავლის ორგანული ქიმია.
ქიმიური თვისებები |
ჩვეულებრივი ტემპერატურის პირობებში ნახშირბადი ქიმიურად ინერტულია, საკმაოდ მაღალი ტემპერატურის დროს კი უერთდება ბევრ ელემენტს, ავლენს ძლიერ აღმდგენ თვისებებს. სხვადასხვა ფორმის ნახშირბადის ქიმიური აქტივობა მცირდება რიგის მიხედვით: ამორფული ნახშირბადი, გრაფიტი, ალმასი, ჰაერზე ისინი აალდებიან შესაბამისად უფრო მაღალ ტემპერატუერაზე ვიდრე 300—500 °C, 600—700 °C და 850—1000 °C.
დაჟანგვის ხარისხი +4, −4, იშვიათად +2 (СО, ლითონების კარბიდები), +3 (C2N2, ჰალოგენციანები); იონიზაციის ენერგია თანმიმდევრობითი გადასვლით С0 დან С4+-მდე შესაბამისად 11,2604, 24,383, 47,871 და 64,19 ევ.
არაორგანული შენაერთები |
ნახშირბადი რეაგირებს ბევრ ელემენტთან. ნაერთებს არალითონებთან აქვს თავისი სახელწოდება — მეთანი, ტეტრაფტორმეთანი.
ნახშირბადის ჟანგბადში წვის პროდუქტებია CO და CO2 (ნახშირბადის მონოქსიდი და ნახშირბადის დიოქსიდი შესაბამისად). ცნობილია ასევე არამდგრადი ოქსიდი С3О2 (დნობის ტემპერატურა −111 °C, დუღილის ტემპერატურა 7 °C) და სხვა ზოგი ოქსიდი. გრაფიტი და ამორფული ნახშირბადი იწყებს რეაგირებას წყალბადთან ტემპერატურაზე 1200 °C, ფთორთან 900 °C-ის დროს.
ნახშირორჟანგი (ნახშირბადის დიოქსიდი) რეაგირებს წყალთან, რომელიც წარმოქმნის სუსტ ნახშირმჟავას — H2CO3, რომლებიც წარმოქმნიათ მარილებს — კარბონატებს. დედამიწაზე ფართოდაა გავრცელებული კარბონატები: კალციუმის კარბონატი (მინერალური ფორმებია — ცარცი, მარმარილო, კალციტი, კირქვა და სხვა) და მაგნიუმის კარბონატი (მინერალური ფორმაა დოლომიტი).
გრაფიტი ჰალოგენებთან, ტუტე ლითონებთან და სხვა. ნივთიერებთან წარმოქმნიან კლატრატებს. ელექტრო მუხტის გატარებისას ნახშირის ელექტროდებს შორის აზოტის ატმოსფეროში წარმოიქმნება ციანი. მაღალი ტემპერატურების დროს ნახშირბადის ურთიერთქმედებით Н2 და N2 ნარევებთან მიიღებენ სინილის მჟავას (ციანის მჟავა): NH3+CH4 →Pt HCN+3H2displaystyle ~mathrm NH_3+CH_4 xrightarrow Pt HCN+3H_2
ნახშირბადის გოგირდთან ურთიერთქმედებისას წარმოიქმნება გოგირდნახშირბადი CS2, ცნობილია ასევე CS და C3S2. ლითონების უმრავლებოსთან, ბორთან და სილიციუმთან ნახშირბადი ქმნის კარბიდებს, მაგალითად:
4Al+3C →t Al4C3displaystyle ~mathrm 4Al+3C xrightarrow t Al_4C_3 (ალუმინის კარბიდი);
Ca+2C →t CaC2displaystyle ~mathrm Ca+2C xrightarrow t CaC_2 (კალციუმის კარბიდი).
მრეწველობისთვის მნიშვნელოვანია ნახშირბადისა და წყლის ორთქლის რეაქცია:
C+H2O⟶CO+H2displaystyle ~mathrm C+H_2Olongrightarrow CO+H_2 (იხ. მყარი საწვავების გაზიფიკაცია).
გახურებისას ნახშირბადი აღადგენს ლითონებს ლითონების ოქსიდებიდან. ეს თვისება ფართოდ გამოიყენება მეტალურგიულ მრეწველობაში.
ორგანული ნაერთები |
ნახშირბადის თვისების გამო - წარმოქმნას პოლიმერული ჯაჭვები, არსებობს ნახშირბადის საფუძველზე ნაერთების დიდი კლასი, რომლებიც მნიშვნელოვნად ბევრია, ვიდრე არაორგანული ნაერთები, და რომლებსაც შეისწავლის ორგანული ქიმია. მათ შორის ყველაზე ფართო ჯგუფებია: ნახშირწყალბადები, ცილები, ცხიმები და სხვა.
ნახშირბადის ნაერთები შეადგენენ დედამიწის სიცოცხლის საფუძველს, ხოლო მათი თვისება განსაზღვრავს პირობების სპექტრს, სადაც მსგავს სიცოცხლის ფორმებს შეუძლიათ არსებობა. ცოცხალ უჯრედებში ატომების რაოდენობის მიხედვით ნახშირბადი შეადგენს მიახლოებით 25 %, მასური წილის მიხედვით - მიახლოებით 18 %.
გამოყენება |
გრაფიტი გამოიყენება ფანქრების წარმოებაში. ასევე მას იყენებენ საპოხ მასალას განსაკუთრებულად მაღალ ან დაბალ ტემპერატურებზე.
ალმასი, განსაკუთრებული სიმაგრის გამო, შეუცვლელლია როგორც აბრაზიული მასალა. ალმაზის დეპონირება აქვს ბორმანქანებს. ამას გარდა, დაწახნაგებული, დამუშავებული ალმასი — ბრილიანტი გამოიყენება როგორც ძვირფასი ქვა ოქრომჭედლობაში. თავისი იშვიათობის, მაღალი დეკორატიული თვისებების და ისტორიული გარემოებების გამო, ბრილიანტი უცვლელად წარმოადგენს ყველაზე ძვირადღირებულ ძვირფას ქვას.
ალმასის განსაკუთრებულად მაღალი თბოგამტარობის გამო (2000 ვტ/მ·К) ის ხდება პერსპექტიულ მასალად ნახევარგამტარულ თექნიკაში ცენტრალური პროცესორის საფენად. მაგრამ შედარებით მაღალი ფასი (მიახლოებით 50 დოლ/გრ) და დამუშავების სირთულე ზღუდავს მის გამოყენებას ამ დარგში.
ფარმაკოლოგიაში და მედიცინაში ფართოდ გამოიყენება ნახშირბადის სხვადასხვაგვარი ნაერთები — ნახშირმჟავას და კარბონის მაჟავის წარმოებულები, სხვადასხვანაირი ჰეტეროციკლები, პოლიმერები და სხვა ნაერთები. კარბოლენი (აქტივირებული ნახშირი), გამოიყენება ორგანიზმიდან სხვადასხვა ტოქსინების აბსორბაციისათვის და მათი გამოყვანისათვის გარეთ; გრაფიტი (მალამოების სახით) — კანის დაავადებების სამკურნალოდ; რადიოაქტიული ნახშირბადის იზოტოპები — მეცნიერული კვლევებისათვის (რადიონახშირბადული ანალიზი).
ნახშირბადი თამაშობს უდიდეს როლს ადამიანის ცხოვრებაში. მისი გამოყენება ისეთივე მრავალფეროვანია, როგორც ამ ელემენტის მრავალსხაეობა.
ნახშირბადი წარმოადგენს ყველა ცოცხალი ორგანიზმის საფუძველს. ყველა ცოცხალი ორგანიზმი მნიშვნელოვანწილად შედგება ნახშირბადისაგან. ნახშირბადი - სიცოცხლის საფუძველია. ნახშირბადის წყაროს ცოცხალი ორგანიზმებისათვის წარმოადგენს ჩვეულებრივ СО2 ატმოსფეროდან და წყლიდან. ფოტოსინთეზის შედეგად ის ხვდება კვების ბიოლოგიურ ჯაჭვში, სადაც ცოცხალი არსებები ჭამენ ერთმანეთს ან ერთმანეთის ნაშთს, რის შედეგაც მოიპოვებენ ნახშირბადს თავისი სხეულის განსავითარებლად. ნახშირბადის ბიოლოგიური ციკლი მთავრდება ან ჟანგვით და ატმოსფეროში დაბრუნებით ან წიაღისეულ შრეებად ნახშრისა და ნავთობის სახით.
ნახშირბადი წიაღისეული საწვავის სახით არის: ქვანახშირი და ნახშირწყალბადები (ნავთობი, ბუნებრივი აირი) — ერთ-ერთი მთავარი მნიშვნელოვანი ენერგიის წყარო ადამიანისათვის.
ტოქსიკური მოქმედება |
ნახშირბადი შედის ატმოსფერული აეროზოლების შემადგენლობაში, რის შედეგად შეიძლება შეცვალოს რეგიონალური კლიმატი, შემცირდეს მზიანი დღეების რაოდენობა. ნახშირბადი გარემოში ხვდება: მურის სახით ავტომანქანების გამონაბოლქვის შემადგენლობაში, ნახშირის წვის დროს თბოელექტროსადგურებში, ნახშირის ღია მოპოვებისას, მისი მიწისქვეშა გაზიფიკაციისას, ნახშირის კონცენტრატების მიღებისას და სხვა. ნახშირბადის კონცენტრაცია წვის წყაროს ზემოთ არის 100—400 მკგ/მ³, მსხვილ ქალაქებში 2,4—15,9 მკგ/მ³, სოფლის რაიონებში 0,5 — 0,8 მკგ/მ³. ატომური ელ. სადგურების აეროზოლური გამონაბოლქვით ატმოსფეროში ხვდება (6—15)×109 ბკ/დღეღამე 14СО2.
ნახშირბადის მაღალი შემცველობა ატმოსფერულ აეროზოლებში იწვევს მოსახლეობის დაავადების ზრდას, განსაკუთრებულად ზედა სასუნთქი გზების და ფიტვების. პროფესიული დაავადებები — ძირითადად ანტრაკოზი და ბრონქიტი. სამუშაო ზონის ჰაერში, მგ/მ³: ალმასი 8,0, ანტრაციტი და კოქსი 6,0, ქვანახშირი 10,0, ტექნიკური ნახშირბადი და ნახშიბადიანი მტვერი 4,0; ათმოსფერულ ჰაერში ერთჯერადად მაქსიმალური 0,15, საშუალო დღეღამური 0,05 მგ/მ³.
ტოქსიკური მოქმედება 14С, ცილების მოლეკულების შემადგენლობაში (განსაკუთრებულად დნმ), განისაზღვრება მსი რადიაციული ურთიერთქმედებით β-ნაწილაკებთან (14С (β) → 14N), რომელიც იწვევს ცვლილებებს მოლეკულის ქიმიურ შემადგენლობაში. დასაშვები კონცენტრაცია 14С სამუშაო ზონის ჰაერში არის А 1,3 ბკ/ლ, ატმოსფერულ ჰაერში Б 4,4 ბკ/ლ, წყალში 3,0×104 ბკ/ლ, ზღვრული დასაშვები ნორმა სასუნთქი ორგანოებიდან 3,2×108 ბკ/წელი.
იხილეთ აგრეთვე |
- რადიონახშირბადული ანალიზი
- ორთოკარბონის მჟავა
- ნახშირბადის ალოტროპიული ფორმები
- ნახშირბადის იზოტოპები
ლიტერატურა |
- ჰიპერკოორდინირებული ნახშირბადის ქიმია, თარგმნ. ინგლ., მ., 1990.
- Kirk — Othmer encyclopedia, 3 ed., vol.4, N.-Y., 1978, p. 556-709.
ბუნებრივი ენერგომატარებლების და ნახშირბადული მასალების ქიმია ტ. ვ. ბიხარკინა, ნ. გ. დიგუროვი- В.І. Саранчук, В. В. Ошовський, Г. О. Власов. Хімія і фізика горючих копалин . — Донецьк: Східний видавничий дім, 2003. ?204 с.
- სლადკოვი ა. მ., კუდრიავცევი ი. პ. ალმასი, გრაფიტი, კარბინი — ნახშირბადის ალოტროპიული ფორმები // პრიროდა. 1969.№ 5. С.37-44.
წყაროები |
- ნახშირბადი Webelements-ზე
- ნახშირბადი ქიმიური ელემენტების პოპულარულ ბიბლიოთეკაში
- ინფორმაცია ნახშირბადზე
ალექსეი სლადკოვის ნახშირბადი — კარბინის აღმოჩენის ისტორია- სლადკოვი კარბინი — ნახშირბადის მესამე ალოტროპილი ფორმა: მონოგრაფია
სქოლიო |
↑ ა. ბორისოვა. (30.07.2010) ქიმიკოსებმა გააბრტყელეს ნახშირბადი. Gazeta.ru. წაკითხვის თარიღი: 2010-08-22.
↑ V. I. Kasatochkin, A. M. Sladkov, et al., Dokl. Akad. Nauk SSSR, 177, No. 2, 358 (1967)
პერიოდული ცხრილი | |||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
H | | He | |||||||||||||||||||||||||||||||||||||||
Li | Be | | B | C | N | O | F | Ne | |||||||||||||||||||||||||||||||||
Na | Mg | | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||||||||||
K | Ca | | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||||||||||
Rb | Sr | | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||||||||||
Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||
Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Uuq | Uup | Uuh | Uus | Uuo | ||||||||||
| | |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
პორტალი ქიმია |
(RLQ=window.RLQ||[]).push(function()mw.log.warn("Gadget "ReferenceTooltips" was not loaded. Please migrate it to use ResourceLoader. See u003Chttps://ka.wikipedia.org/wiki/%E1%83%A1%E1%83%9E%E1%83%94%E1%83%AA%E1%83%98%E1%83%90%E1%83%9A%E1%83%A3%E1%83%A0%E1%83%98:Gadgetsu003E."););
კატეგორია:
- ნახშირბადის ნაერთები
- ქიმიური ელემენტები
- არალითონები
- ნახშირბადი
(RLQ=window.RLQ||[]).push(function()mw.config.set("wgPageParseReport":"limitreport":"cputime":"0.388","walltime":"0.491","ppvisitednodes":"value":1023,"limit":1000000,"ppgeneratednodes":"value":0,"limit":1500000,"postexpandincludesize":"value":25221,"limit":2097152,"templateargumentsize":"value":3221,"limit":2097152,"expansiondepth":"value":10,"limit":40,"expensivefunctioncount":"value":0,"limit":500,"unstrip-depth":"value":0,"limit":20,"unstrip-size":"value":1083,"limit":5000000,"entityaccesscount":"value":0,"limit":400,"timingprofile":["100.00% 151.925 1 -total"," 29.49% 44.796 1 თარგი:სქოლიო"," 16.50% 25.061 1 თარგი:პერიოდული_ცხრილი"," 14.16% 21.517 3 თარგი:Main"," 12.48% 18.958 1 თარგი:Tnavbar-collapsible"," 10.05% 15.261 1 თარგი:ქიმიური_ელემენტი"," 9.85% 14.963 1 თარგი:Navbar"," 7.83% 11.895 1 თარგი:Cite_web"," 6.71% 10.194 3 თარგი:მულტიპარამეტრი-ბმულით"," 5.51% 8.371 1 თარგი:Lang-la"],"scribunto":"limitreport-timeusage":"value":"0.003","limit":"10.000","limitreport-memusage":"value":551397,"limit":52428800,"cachereport":"origin":"mw1247","timestamp":"20190919103015","ttl":2592000,"transientcontent":false););"@context":"https://schema.org","@type":"Article","name":"u10dcu10d0u10eeu10e8u10d8u10e0u10d1u10d0u10d3u10d8","url":"https://ka.wikipedia.org/wiki/%E1%83%9C%E1%83%90%E1%83%AE%E1%83%A8%E1%83%98%E1%83%A0%E1%83%91%E1%83%90%E1%83%93%E1%83%98","sameAs":"http://www.wikidata.org/entity/Q623","mainEntity":"http://www.wikidata.org/entity/Q623","author":"@type":"Organization","name":"Contributors to Wikimedia projects","publisher":"@type":"Organization","name":"Wikimedia Foundation, Inc.","logo":"@type":"ImageObject","url":"https://www.wikimedia.org/static/images/wmf-hor-googpub.png","datePublished":"2010-11-28T09:46:15Z","image":"https://upload.wikimedia.org/wikipedia/commons/4/4b/Diamond-and-graphite-with-scale.jpg"(RLQ=window.RLQ||[]).push(function()mw.config.set("wgBackendResponseTime":206,"wgHostname":"mw1241"););




