Osmoza Sadržaj Mehanizam osmoze | Povratna osmoza | Izvori | Navigacijski izbornik
Stanična biologijaKemija
grčdifuzijakoncentracijaotopiniotapalupolupropusnom membranomtvartlakastanicemembranamolekuleionekoncentracijamakinetičkom teorijomvolumenahidrostatski tlakdifuzijestanicamembranomsili težitlakommodre galiceVodahidrostatskogšećerneotopineNmm2barstanicicitoplazmelizeorganskihcarstvu![]() pitke vodeslane vodesoliTlakbaramonijakugljikov dioksidmolekuleaktivnim ugljenombakterijevirusikloriranjeozonUVsunčeva dezinfekcijafiltriranjapročišćavanje vodemineralasolistandardemolekulemedicinske
pitke vodeslane vodesoliTlakbaramonijakugljikov dioksidmolekuleaktivnim ugljenombakterijevirusikloriranjeozonUVsunčeva dezinfekcijafiltriranjapročišćavanje vodemineralasolistandardemolekulemedicinske
(function()var node=document.getElementById("mw-dismissablenotice-anonplace");if(node)node.outerHTML="u003Cdiv class="mw-dismissable-notice"u003Eu003Cdiv class="mw-dismissable-notice-close"u003E[u003Ca tabindex="0" role="button"u003Esakriju003C/au003E]u003C/divu003Eu003Cdiv class="mw-dismissable-notice-body"u003Eu003Cdiv id="localNotice" lang="hr" dir="ltr"u003Eu003Ccenteru003EU tijeku je izbor u003Cbu003Eu003Ca href="/wiki/Wikipedija:Jubilarni_%C4%8Dlanci/205_000_%C4%8Dlanaka" title="Wikipedija:Jubilarni članci/205 000 članaka"u003Ejubilarnog 205.000.u003C/au003Eu003C/bu003E članka.u003C/centeru003Eu003C/divu003Eu003C/divu003Eu003C/divu003E";());
Osmoza
Prijeđi na navigaciju
Prijeđi na pretraživanje

1.čaša: dvije otopine različitih koncentracija odvojene polupropusnom membranom, vidimo čestice otopljene tvari, 2.čaša: voda prelazi na desnu stranu od polupropusne membrane i time teži izjednačavanju koncentracija.

Voda prolazi kroz polupropusnu membranu ako su odijeljenje dvije tekućine različitih koncentracija.


Osmoza (prema grč. ὠσμός: guranje, tiskanje) je difuzija kojom se izjednačuju koncentracija u otopini i otapalu, odnosno koncentracije dviju otopina različitih koncentracija, međusobno odijeljenih polupropusnom membranom, to jest takvom koja propušta otapalo, ali zaustavlja otopljenu tvar. U novonastaloj otopini, odnosno u otopini veće koncentracije, nastaje pri osmozi povišenje tlaka koje se naziva osmotski tlak; njegova je jačina proporcionalna koncentraciji otopine. Osmoza se javlja u biljnim i životinjskim organizmima, gdje stanične membrane imaju svojstvo polupropusnosti, a postoji razlika u koncentraciji otopine unutar i izvan stanice. [1]
Sadržaj
1 Mehanizam osmoze
1.1 Osmoza i difuzija
1.2 Stanična osmoza
2 Povratna osmoza
3 Izvori
Mehanizam osmoze |
Osmoza je proces u kojem polupropusna membrana odvaja dvije otopine različitih koncentracija. Polupropusna membrana propušta molekule otapala dok ne propušta čestice otopljenih tvari (ione ili molekule). Molekule otapala se zbog razlike u koncentracijama otopina gibaju s mjesta manje koncentracije prema mjestu veće koncentracije. Proces ima težnju odvijanja sve do izjednačenja koncentracija s obje strane membrane; manje koncentrirana otopina postaje koncentriranija, više koncentriranoj otopini se smanjuje koncentracija. Pojava se može najjednostavnije objasniti kinetičkom teorijom i činjenicom da na strani otopine s manjom koncentracijom otopljenih tvari ima više molekula otapala (vode) koje zato prelaze na stranu s manje molekula otapala.
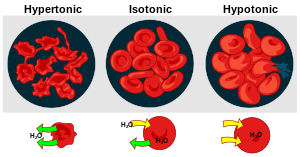
Pri prolasku molekula otapala kroz membranu dolazi do porasta volumena otopine na jednoj strani membrane i smanjenja volumena otopine na drugoj strani. Porast volumena otopine na jednoj strani stvara hidrostatski tlak koji se suprotstavlja osmozi, to jest osmotskom tlaku koji djeluje na membranu. Kada se ova dva tlaka izjednače, uspostavit će se dinamična ravnoteža, to jest više neće doći do podizanja razine otopine, dok molekule otapala i dalje prolaze kroz membranu ali u oba smjera jednako intenzivno. Tlak pri kome se uspostavlja ova ravnoteža naziva se efektivni osmotski tlak. Osmotski je tlak veći što je razlika koncentracija otopina veća, i obrnuto. Molekule otapala se gibaju iz otopine s nižom (hipotonična otopina) u otopinu s višom koncentracijom otopljene tvari (hipertonična otopina). Osmozu možemo promatrati kao poseban slučaj difuzije. Osmolaritet je relativna koncentracija otopljene tvari u sredini u kojoj se nađe stanica.
Osmoza i difuzija |
Difuzija se ne zbiva samo između kemijskih tvari koje se dodiruju, nego također između tvari koje su odijeljene nekom pregradom, odnosno membranom. Osim toga, difuzija tekućine može postojati i kroz pregrade nasuprot sili teži, i to s izvjesnim tlakom koji se naziva osmotski tlak. Ako na primjer odijelimo otopinu modre galice i vodu nekom membranom (na primjer životinjskim mjehurom) vidjet ćemo da voda mnogo brže prodire kroz membranu u modru galicu nego modra galica u vodu. Voda će dotle prodirati dok ne nastupi ravnoteža između hidrostatskog i osmotskog tlaka.
Difuzija kroz propusne ili polupropusne membrane (stijenke) naziva se osmoza. Tlak koji zbog različite koncentracije otopina tjera tekućinu u smjeru veće koncentracije naziva se osmotski tlak. Pri dodiru dviju tekućina različitih koncentracija tekućine nastoje svoju koncentraciju izjednačiti difuzijom. Budući da molekule modre galice ne mogu tako brzo prolaziti kroz polupropusnu membranu u vodu, to se koncentracija izjednačuje na taj način da voda prodire u otopinu modre galice i njezinu koncentraciju izjednačuje.
Osmotski tlak je kod nekih otopina vrlo velik, tako je na primjer kod šećerne otopine 60 000 N/mm2 (0,6 bar). Osmoza je važna za žive organizme. Stijenke stanica su opne koje propuštaju samo one tvari koje su organizmu potrebne za hranu. [2]
Stanična osmoza |
Osmoza u stanici nastupa zbog razlike u osmolaritetu citoplazme s unutrašnje, i otopine s vanjske strane membrane, što dovodi do smežuravanja ili bubrenja stanice. Češća pojava bubrenja i lize stanice nastupa zbog veće koncentracije otopljenih iona i malih organskih molekula u stanici, zbog čega je ona hipertonična u odnosu na svoju okolinu, pa voda ulazi u stanicu. Stanice se problemu visokog osmolariteta prilagođavaju, ovisno o carstvu kojem pojedini organizam pripada:
- Stanice biljaka, alga, gljiva, i većine bakterija obavijene sustaničnom stijenkom koja je dovoljno čvrsta da spriječi rasprsnuće stanice u hiptonočnoj otopini. U njima se, uslijed ulaska vode, stvara turgorski tlak koji onu količinu vode koja uđe tjera van, pa su biljna tkiva iznimno jaka. U hipetoničnoj otopini izlazak vode uzrokuje odvajanje membrane od stanične stijenke, te dovodi do procesa plazmolize i uvenuća biljke.
Životinjske stanice problem osmolariteta rješavaju aktivnim izbacivanjem anorganskih iona i smanjivanjem razlike u koncentracijama otopljenih tvari (prvenstveno natrija) između stanice i njezine okoline (natrij-kalijeva crpka ili Na|K crpka). Pri tome troše značajne količine energije.

Prikaz rada povratne osmoze kod desalinizacije morske vode korištenjem izmjenjivača tlaka:
1: Ulaz morske vode,
2: Izlaz slatke vode (40%),
3: Otpadna voda (60%),
4: Protok morske vode (60%),
5: Koncentrirani odvod (gušći od morske vode),
A: Protočna crpka (40%),
B: Protočna crpka,
C: Uređaj za povratnu osmozu s polupropusnom membranom,
D: Izmjenjivač tlaka.
Povratna osmoza |
![]() Podrobniji članak o temi: Povratna osmoza
Podrobniji članak o temi: Povratna osmoza
Povratna osmoza, obrnuta osmoza ili reverzna osmoza je metoda koja služi za dobivanje pitke vode iz slane vode. Postupak koristi polupropusnu membranu kroz koju prolazi čista voda a zaostaju soli. Tlak slane vode mora biti oko 25 bar, što ovu metodu čini skupom za proizvodnju većih količina svježe vode. Kloridi, amonijak i ugljikov dioksid su male molekule pa prolaze polupropusnu membranu, te ih treba naknadno ukloniti aktivnim ugljenom. Neke bakterije i virusi takoder prolaze polupropusnu membranu, pa i njih treba dezinficirati (kloriranje, ozon, UV svjetiljka, sunčeva dezinfekcija). [3]
Povratna osmoza ili reverzna osmoza je skoro savršen proces filtriranja vode. Ovaj proces omogućuje odstranjivanje najsitnijih čestica iz vode. Povratna osmoza se koristi za pročišćavanje vode i odstranjivanje neorganskih minerala, soli i ostalih nečistoća u cilju poboljšanja izgleda, ukusa i ostalih svojstava vode. Tako se dobija kvalitet voda za piće koji zadovoljava sve standarde voda za piće. Nakon poznatih načina prečišćavanje vode industrijskom filtracijom (gradski vodovod i tvornice), prokuhavanjem i kloriranjem, došlo se do tehnički skoro savršenog načina filtriranja vode, koji gotovo od svake zagađene vode može načiniti zdravu pitku voda. Osmotske membrane koje se koriste u ovom postupku imaju toliko sitne otvore da kroz njih mogu proći gotovo samo molekule čiste vode, a sve nečistoće ostaju na membrani i izbacuju se preko odvoda kao tehnička otpadna voda. Ovakvim načinom filtracije vode dobiva se voda za piće visoke kvalitete, koja se može koristiti i u medicinske svrhe (voda za bebe). [4]
Izvori |
↑ osmoza, [1] "Hrvatska enciklopedija", Leksikografski zavod Miroslav Krleža, www.enciklopedija.hr, 2017.
↑ Velimir Kruz: "Tehnička fizika za tehničke škole", "Školska knjiga" Zagreb, 1969.
↑ [2] "Reverzna osmoza", Englesko-hrvatski kemijski rječnik & glosar, www.glossary.periodni.com, 2012.
↑ [3] "Kondicioniranje vode", www.grad.unizg.hr, 2012.
Kategorije:
- Stanična biologija
- Kemija
(window.RLQ=window.RLQ||[]).push(function()mw.config.set("wgPageParseReport":"limitreport":"cputime":"0.052","walltime":"0.074","ppvisitednodes":"value":319,"limit":1000000,"ppgeneratednodes":"value":0,"limit":1500000,"postexpandincludesize":"value":1991,"limit":2097152,"templateargumentsize":"value":862,"limit":2097152,"expansiondepth":"value":5,"limit":40,"expensivefunctioncount":"value":0,"limit":500,"unstrip-depth":"value":0,"limit":20,"unstrip-size":"value":1607,"limit":5000000,"entityaccesscount":"value":0,"limit":400,"timingprofile":["100.00% 29.348 1 -total"," 24.81% 7.281 1 Predložak:Izvori"," 24.36% 7.148 1 Predložak:Multiple_image"," 13.35% 3.917 1 Predložak:Glavni"],"cachereport":"origin":"mw1254","timestamp":"20190427123312","ttl":2592000,"transientcontent":false););"@context":"https://schema.org","@type":"Article","name":"Osmoza","url":"https://hr.wikipedia.org/wiki/Osmoza","sameAs":"http://www.wikidata.org/entity/Q54237","mainEntity":"http://www.wikidata.org/entity/Q54237","author":"@type":"Organization","name":"Contributors to Wikimedia projects","publisher":"@type":"Organization","name":"Wikimedia Foundation, Inc.","logo":"@type":"ImageObject","url":"https://www.wikimedia.org/static/images/wmf-hor-googpub.png","datePublished":"2005-12-21T14:28:03Z","dateModified":"2018-01-18T19:11:21Z","image":"https://upload.wikimedia.org/wikipedia/commons/6/62/0307_Osmosis.jpg"(window.RLQ=window.RLQ||[]).push(function()mw.config.set("wgBackendResponseTime":115,"wgHostname":"mw1270"););