خاصية أسموزية محتويات أمثلة على عملية التناضح تفسير أساسي أمثلة من التناضح تحلية المياه تطبيق قانون الغازات الصيغة الترموديناميكية الضغط الأسموزي للمحاليل غير المثالية الضغط الأزموزي في الكائنات الحية تطبيقات المراجع انظر أيضاً قائمة التصفحالهيئة الذرية السوريةنسخة محفوظةترجمة Osmosisجامعة أم القرىنسخة محفوظةويب طبنسخة محفوظةترجمة Osmosisكتاب الأحياء للصف الحادي عشر، الجزء الأول، صفحة 41، دولة فلسطيننسخة محفوظةكتاب الأحياء للصف الحادي عشر العلمينسخة محفوظةكتاب الأحياء للصف الأول الثانوي، صفحة 108، دولة اليمننسخة محفوظةكتاب الأحياء للصف الأول الثانوي، صفحة 28، الجماهيرية الليبيةالمعجم الطبيبنك باسم للمصطلحات، مجال علم الأحياء والطب البيطرينسخة محفوظةكتاب المعلم لمادة الأحياء، الصف الحادي عشر، الجزء الأول، صفحة 6، فصل الاتزان الداخلي والنقل، دولة الإمارات العربية المتحدةنسخة محفوظةكتاب الأحياء للصف الأول الثانوي، صفحة 26، الجماهيرية الليبيةبنك باسم للمصطلحاتنسخة محفوظةStatkraft: Osmotic Power (PDF, engl.)Bericht der Financial Times Deutschland vom 23. Jan. 2008Statkraft Pressemitteilungنسخة محفوظة4043973-200571168
انتشارتقانة الأغشيةتقنية المياهغشاء حيويفيزياء حيوية
باليونانيةبالإنجليزيةجزيئاتالماءنصف نافذكثافةطاقةالنصف نافذالمذيبالذوائبتدرجالضغطشبه نافذخليةغازاالضغط الإسموزيخليةالماءالكرزالضغط الإسموزيالضغط الإسموزيللغازات المثاليةقانون بويلوقانون جاي-لوساكوقانون أفوجادروالضغط الإسموزيقانون فان هوفالضغط الإسموزيالضغط الإسموزيباسكالنظام مغلقالإنثالبي الحرطاقة غيبس الحرةأنتروبية النظامالتوازن الترموديناميكيالكمونات الكيميائيةقانون فان هوفالكمون الكيميائيالتوازن الترموديناميكيالإنثالبي الحرطاقة غيبس الحرةدرجة حرارةالضغط الأزموزيالضغط الأزموزيالتركيزات الموليةالكمونات الكيميائيةالفاعلية الكيميائيةالضغط الأزموزيللضغط الأزموزيالحيوانات الفقريةالدموالبلازمابالإنجليزيةمحلول منظمجبلة مجردةالعلاج بالقسطرة الوريديةالضغط الأزموزيملح الطعاملبلازما الدمميجا باسكالبالقسطرة الوريديةغسيل الكلىبروتينديال الدمالطبهندسة العمليات الصناعيةالضغطالضغطتركيزطاقةالضغطتبخيربطاقة حراريةمحطة تناضح عكسيقوانين الترموديناميكاالشغلالكمون الكيميائيعنفةمولد كهربائيميجاواتمحطة طاقةالنرويجخليج أوسلوبالنرويجية
خاصية أسموزية
اذهب إلى التنقل
اذهب إلى البحث
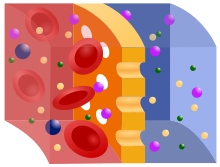
غشاء نصف نافذ، تنفذ خلاله الجسيمات الصغيرة ولا تنفذ الجسيمات الكبيرة .

تأثير ضغط التناضح على خلية الدم الحمراء

حالات الضغط التناضحي في الخلية النباتية.
التناضح[1][2][3][4][5][6][7] أو الخاصية الأسموزية[8][9][10][11][12][13][14][15] أو الحلول أو التنافذ[7] أو الأزموزية[7][16][17] أو التنافذ الغشائي[16][17] أو الأسموزية[18][19][20][21] أو الانتضاح[22] أو الانتشار الغشائي[22] (باليونانية: ὠσμός «دفع») (بالإنجليزية: Osmosis)، هي صافي حركة انتقال جزيئات الماء عبر غشاء نصف نافذ من منطقة ذات كثافة مائية مرتفعة (تركيز مخفف للذوائب) إلى منطقة ذات كثافة مائية منخفضة (تركيز أعلى للذوائب) دون الحاجة لاستهلاك طاقة. الغشاء النصف نافذ يسمح بنفوذ الماء (المذيب) ولا يسمح بنفوذ الذوائب (solute) مما يؤدي إلى تدرج في الضغط عبر الغشاء.
نأتي بأنبوب زجاجي ذو فرعين على شكل U ونفصل بين فرعيه بوضع غشاء نصف نافذ. ونملأ الفرع اليميني بالماء ونملأ الفرع اليساري بمحلول ماء مذاب فيه ملح، بحيث يكون ارتفاع عامود الماء في الفرع اليميني مساويا لارتفاع المحلول الملحي في الفرع اليساري وننتظر بعضا من الوقت. نشاهد بعد فترة من الزمن أن عمود الماء في الفرع اليميني ينخفض، ويرتفع عامود المحلول في الفرع اليساري. ويظل الماء في فرعه خاليا من الملح، ويبقى الملح محصورا في عموده.
ويظل الماء ينتقل عبر الغشاء من عامود الماء النقي إلى عامود المحلول الملحي حتي يصل إلى نهاية عظمى عند ارتفاع ثابت. ويسمى فرق ارتفاع عمودي الماء والمحلول بالضغط الإسموزي أو ضغط التناضح.
محتويات
1 أمثلة على عملية التناضح
2 تفسير أساسي
3 أمثلة من التناضح
4 تحلية المياه
5 تطبيق قانون الغازات
6 الصيغة الترموديناميكية
7 الضغط الأسموزي للمحاليل غير المثالية
8 الضغط الأزموزي في الكائنات الحية
9 تطبيقات
9.1 قياس الأسمولية
9.2 غسيل الكلى
9.3 تناضح عكسي
9.4 محطة قوى بالضغط الأزموزي
10 المراجع
11 انظر أيضاً
أمثلة على عملية التناضح
عملية التناضح عملية حيوية وموجودة في العديد من العمليات الطبيعية ومنها:
- انتقال الماء من وإلى الخلايا الحية مثل خلايا النباتات والهيموغلوبين وخلايا بشرية أخرى وغيرها.
- يستغل التناضح في التقنية لفصل المواد، وطبيا في الغسيل الكلوي (تنقية دم المريض من البول عند مرضى الكلى المصابين بقصور كبير في عمل الكلى).
تفسير أساسي

في التناضح يمر الماء عبر الغشاء إلى محلول الملح حتى حدوث توازن للضغط على الجهتين.( إلى اليسار : بداية التجربة، إلى اليمين: نهاية التجربة.)
يقع التناضح عند وجود غشاء شبه نافذ. عند إغراق خلية في كأس من الماء جزيئات الماء تمرّ من الوسط المنخفض التركيز (hypotonic) خارج الخلية إلى الوسط مرتفع التركيز (hypertonic) في الخلية عبر الغشاء شبه النافذ لتحقيق حالة توازن للضغط (isotonic) . الغشاء نافذ بطريقة انتقائية فهو يسمح فقط بمرور مواد معينه ويمنع مرور مواد غيرها .
تفسير مرور الماء عبر الغشاء النصف نافذ من الماء إلى محلول ملحي : تتصرف حبيبات الملح الذائبة في الماء كما لو كانت غازا ، ويكون لها ضغط معين يعتمد على تركيز المحلول . هذا الضغط يحاول أن يزيد من حجمه وذلك بالضغط على سطح المحلول في الأنبوب من أسفل إلى أعلى . فيرتفع سطح المحلول ساحبا معه ماء من الناحية الأخرى للغشاء (الغشاء يسمح بمرور جزيئات الماء ولا يسمح بمرور جزيئات الملح) . يرتفع عمود المحلول تحت هذا الضغط الداخلي فيه (ضغط جزيئات الملح) وينخفض عمود الماء في ناحية الماء النقي.
أمثلة من التناضح

ثمرات الكرز.
الضغط التناضحي أو الضغط الإسموزي هو السبب الرئيسي لامتصاص النباتات للماء، فماء التربة بصفة عامة يكون ضغطه التناضحي اقل من الضغط الموجود داخل الشعيرات الماصة في الجذور مما يؤدي إلى مرور الماء من التربة إلى الجذور وليس العكس. عندما توضع خلية من نبتة في محلول مرتفع التركيز تبدأ هذه النبتة في الانكماش بسبب خروج الماء منها وانتشاره في المحلول مرتفع التركيز لتكوين حالة توازن للضغط.
يمكن مشاهدة التناضح كذلك عند وضع شرائح البطاطا في محلول من الماء المالح، فبعد مدة تبدأ هذه الشرائح في فقدان الماء والانكماش. كما نشاهد في مزارع الكريز انفجار ثمرات الكرز عند هطول مطر لمدة طويلة حيث تمتص الثمرة - بما فيها من محلول سكري - ماء زائدا عن الحد ويتمزق غلافها.
تحلية المياه
 مقالة مفصلة: تناضح عكسي
مقالة مفصلة: تناضح عكسي
يُستخدم أسلوب اسمه «الضغط الإسموزي العكسي» لتحلية مياه البحر و مياه الآبار واستخراج ماء عذب منها. تلك العملية تتم بطريقة معكوسة لظاهرة الضغط الإسموزي المعروفة طبيعيا. في تلك الطريقة يوضع الماء المالح تحت ضغط عال، أعلى من الضغط الإسموزي، فتنتقل جزيئات الماء من الماء المالح إلى الماء العذب عبر الغشاء، ونحصل على ماء عذب. تعتمد تلك الطريقة على مقدار الضغط المسلط على المحلول وعلى نوع الغشا. وتوجد أبحاث كثيرة بغرض الوصول إلى التركيبة المثلى للغشاء بالطرق الكيميائية للارتفاع بكفاءة عملية الفصل.
تطبيق قانون الغازات
تنطبق قوانين الغازات للغازات المثالية مثل قانون بويل وقانون جاي-لوساك وقانون أفوجادرو أيضا على حالة سائل مخفف.
فيكون الضغط الإسموزي:
- متناسبا طرديا مع التركيز المولي للمادة المذابة.
- متناسبا طرديا مع درجة الحرارة المطلقة.
- في المحاليل يعتمد الضغط الإسموزي على عدد جسيمات المادة المذابة فقط (تركيزها المولي).
- يبلغ الضغط الإسموزي لمحلول مكون من 1 مول من المذاب في 4و22 لتر سائل مذيب 101,325 كيلوباسكال (1 ضغط جوي قياسي) عند درجة حرارة 273 كلفن (0 درجة مئوية).
تؤدي تلك الشروط إلى قانون فان هوف للضغط الإسموزي : " الضغط الإسموزي يعادل ضغط غاز له نفس العدد من الجسيمات n عند درجة حرارة T " ، فيكون :
- Π=n⋅k⋅T=c⋅R⋅Tdisplaystyle Pi =ncdot kcdot T=ccdot Rcdot T
تعني Πdisplaystyle Pi في هذه المعادلة الضغط الإسموزي بوحدة باسكال.
- c = n/V التركيز المولي في المحلول.
- k ثابت بولتزمان.
- R ثابت الغازات العام.
- T درجة الحرارة المطلقة كلفن.
ينطبق هذا القانون في صورته الحالية على سائل مخفف
(<0,1 مول /لتر) حيث أن قوانين الغازات تنطبق في حالة الضغوط المنخفضة (حيث يكون التآثر بين الجسيمات بعضها البعض مهملا).
الصيغة الترموديناميكية
تجري الظاهرة الأزموزية من تلقاء نفسها فهي عملية «خلط» - تنفصل مادة من طورها وتختلط في مادة أخرى مكونة طور جديد . وتسبب عملية تجري من تلقاء نفسها في نظام مغلق إلى خفض الإنثالبي الحر (طاقة غيبس الحرة) وارتفاع في أنتروبية النظام. وفي حالة الظاهرة الأزموزية تعمل الخاصية المميزة للغشاء النصف نافذ على منع تساوي التركيز على ناحيتي الغشاء عند الوصول إلى التوازن الترموديناميكي - فيوجد لدينا طورين للمادة منفصلان عن بعضهما في جميع الأزمنة. (في الواقع يمكن القول بأن النظام يتكون من ثلاثة أطوار ، إذا أخذنا الغشاء أيضا في الاعتبار).
فيكون التغير في الإنثالبي الحر الكلي في الخلية الأزموزية مساويا لمجموع التغيرين للإنتالبي في طوري النظام :
- dG=dG(1)+dG(2) displaystyle dG=dG^(1)+dG^(2)
حيث الأرقام (1) و (2) مميزة للمحلولين في الخلية الأزموزية على ناحيتي الغشاء النصف نفاذ. وعندما يكون الغشاء نافذا لأحد المواد Ldisplaystyle L (مثل مادة سائل المذيب)، فيمكن وصف العلاقة بين الإنثالبي الحر G وكمية المادة dnLdisplaystyle dn_L بالعلاقتين :
- dG(1)=μ(1) dnLdisplaystyle dG^(1)=mu ^(1) dn_L
- dG(2)=μ(2) dnLdisplaystyle dG^(2)=mu ^(2) dn_L
حيث:
μdisplaystyle mu الكمون الكيميائي الجول
ndisplaystyle n كمية المادة مول التي تعبر الغشاء.
ونظرا لكون الكمية المكتسبة في الطور
(2) يعادل الكمية المفقودة من الطور (1) فينتج للتغير الكلي في الإنثالبي الحر :
- μ(2)dnL=−μ(1)dnLdisplaystyle mu ^(2)dn_L=-mu ^(1)dn_L
وبالتالي :
dG=(μ(1)−μ(2)) dnLdisplaystyle dG=(mu ^(1)-mu ^(2)) dn_L
وطالما لم يصل النظام إلى حالة التزازن الترموديناميكي
(dG>0displaystyle dG>0)، فينطبق بالنسبة إلى الكمونات الكيميائية :
- μ(1)>μ(2)displaystyle mu ^(1)>mu ^(2)
وعند الوصول إلى حالة التوازن
(dG=0displaystyle dG=0):
- μ(1)=μ(2)displaystyle mu ^(1)=mu ^(2)
هذا بالنسبة إلى مادة واحدة مذابة في سائل. أما إذا كان لدينا عدة مواد ذائبة في السائل فلا بد من صياغة العلاقات المذكورة أعلاه بأخذ الكمونات الكيميائية لجميع المواد المذابة في الاعتبار (أنظر قسم الجهد الأزموزي في المحاليل الغير مثالية).
شرط الوصول غإلى حالة التوازن في الظاهرة الأزموزية يعتمد على أن تكون الكمونات الكيميائية للمادة التي تعبر الغشاء (وهي تكون في الغالب السائل المذيب) تكون كموناتها على الناحيتين متساوية. وطالما كان في النظام اختلاف في الكمونين فسوف تنتقل جسيمات للمادة في اتجاه الكمون المنخفض .
الضغط الأسموزي للمحاليل غير المثالية
لا ينطبق قانون فان هوف عل المحاليل غير المثالية (المحاليل المركزة) حيث يحدث فيها تآثر بين الجزيئات بعضها البعض ولا يمكن إهمالها. عندئذ لا بد من استخدام الكمون الكيميائي من معادلة جيبس العامة. في حالة التوازن الترموديناميكي يبلغ الإنثالبي الحر (طاقة غيبس الحرة) في الخلية الأزموزية نهاية صغرى:
- dG=V⋅dp−S⋅dT+∑i=0Nμi⋅dni=0displaystyle mboxdG=Vcdot mboxdp-Scdot mboxdT+sum _i=0^Nmu _icdot mboxdn_i=0
وبافتراض أن العملية تتم في درجة حرارة ثابتة، تتبسط المعادلة إلى :
- 0=V⋅dp+∑i=0Nμi⋅dnidisplaystyle 0=Vcdot mboxdp+sum _i=0^Nmu _icdot mboxdn_i
وعندما يكون الضغط المحيط متساويا يبلغ التغير في الضغط الأزموزي :
- dΠ=−∑i=0Nμi⋅dciVdisplaystyle mboxdPi =-frac sum _i=0^Nmu _icdot mboxdc_iV
أي أن الضغط الأزموزي Πdisplaystyle Pi ينتج من التركيزات المولية cidisplaystyle c_i
الناشئة عن تغير جميع الكمونات الكيميائية μdisplaystyle mu . وقد أخدت في هذه المعادلة تأثيرات الخلط في الاعتبار. وفي أغلب الأحوال نهمل تلك التأثيرات التي تحدث بين المواد الذائبة بعضها البعض وكذلك تركيز السائل المذيب:
- Π=−RTV⋅∑i=1NΔ(ci⋅lnai)displaystyle Pi =-frac RTVcdot sum _i=1^NDelta left(c_icdot ln a_iright)
كما يمكننا تبسيط المعادلة مرة ثانية بإهمال التآثر بين الجزيئات الذائبة وجزيئات السائل المذيب أيضا. في تلك الحالة يمكن اعتبار الفاعلية الكيميائية aidisplaystyle a_i لتلك المواد مساوية 1 ، ونصل إلى معادلة تقريبية:
- Π≈−RTV⋅∑i=1NΔcidisplaystyle Pi approx -frac RTVcdot sum _i=1^NDelta c_i
ولكن يجب ملاحظة أن هذا التقريب يؤدي عند التركيزات العالية إلى أخطاء قد تصل إلى 50 %، خصوصا بسبب إهمالنا للتآثرات بين الجزيئات بعضها البعض.
يُسمى الضغط الأزموزي السالب الإشارة أحيانا «الجهد الأزموزي» ويرمز له بالرمز ψodisplaystyle psi _o.
الضغط الأزموزي في الكائنات الحية
للضغط الأزموزي أهمية كبيرة في تكوين الكائنات الحية وسير العمليات الحيوية فيها. فكل خلية محاطة بغشاء يكون حائلا بالنسبة إلى الانتقال العشوائي للمواد، إلا الماء الذي هو السائل المذيب فيمكنه الانتقال عبر الغشاء. وحتى الخلية نفسها فيوجد في داخلها جسيمات تغطيها أغشية هي الأخرى تسمح بمرور أنواع الجزيئات. وتوجد النباتات في حالة تبادل مستمر مع الماء، حيث تمتص وتنقل وتطرد ماء. وخلايا الحيوانات الفقرية تحيطها سائل الدم والبلازما.
تطبيقات
قياس الأسمولية
يعتبر قياس الأسمولية (بالإنجليزية: Osmolarity) بواسطة الطرق الأزموزية من أحد الأعمال الرئيسية في مجال العلوم البيولوجية. ويستخدم في حالة العمل على خلايا حية محلول منظم لتفادي حدوث تفاعلات غير مرغوبة فيها تحت تأثير الإجهاد الأزموزي. فمثلا عند فصل البروتوبلاست (جبلة مجردة) يمكن أن يتسبب استخدام محلول منظم زائد التركيز في تمزيق . وعند تركيب تلك المحاليل المنظمة في المختبر فيمكن قياس المولية الأزموزية لها ومقارنتها بالقيم المناسبة لها.
في الطب عند العلاج بالقسطرة الوريدية يستخدم محلول ملحي بغرض عدم الاضرار بخلايا الجسم عن طريق الضغط الأزموزي. وهو محلول مكون من الماء ويحتوي على 0,9 % (وزنا ) من ملح الطعام، وتبلغ المولية الأزموزية لهاذا المحلول 330 mosmol/لتر وهي تعادل تقريبا تلك لبلازما الدم، وهو يعادل ضغطا أزموزيا قدره 7و0 ميجا باسكال. أما في حالة استخدام ماء نقيا عند العلاج بالقسطرة الوريدية فقد يؤدي ذلك الفرق في الضغط في انفجار بعض خلايا الدم.
غسيل الكلى
 مقالة مفصلة: غسيل الكلى
مقالة مفصلة: غسيل الكلى
تستخدم أغشية في عملية غسيل الكلى لها خاصية السماح لجزيئات وأيونات يبلغ حجمها أقل من حجم معين، وفي نفس الوقت تكون مانعة لمرور جزيئات بروتين أو أحماض نوكليين. بتلك الطريقة يمكن فصل مواد ذات تركيب جزيئي صغير الحجم وعزلها أو خفض كمياتها إلى مستويات مناسبة . يُملأ - بحسب الطريقة المستخدمة - المحلول الديالي في وعاء (خرطوم ديالي ) ويغطس هذا في محلول ديالي ويبقي فيه فترة زمنية . أو يبقي المحلول المراد دياليته ، مثلما في حالة ديال الدم، معزولا بواسطة غشاء عن محلول التنقية . وتطبق طرق الديال في الطب بغرض تنظيف الدم ، كما تُستغل في الصناعة وفي هندسة العمليات الصناعية (مثل تحضير البيرة الخالية من الكحول ).
تناضح عكسي
 مقالة مفصلة: تناضح عكسي
مقالة مفصلة: تناضح عكسي
يتم التناضح العكسي أو « الضغط الأزموزي المعكوس » عن طريق رفع الضغط في نظام مكون من ماء ومحلول به مادة ذائبة ويفصلهما غشاء نصف نافذ. يعمل رفع الضغط فوق ناحية ماء المحلول على زيادة تركيز المحلول ( يعمل رفع الضغط على المحلول على إجبار جزيئات الماء المرور عبر الغشاء في الاتجاه المعاكس ، أي من المحلول إلى الماء العذب). وتستخدم تلك الطريقة في فصل الماء العذب عن ماء البحر المالحة. ولكن لا بد من بذل طاقة لتوليد هذا الضغط.
(في عملية استخلاص ماء عذب من ماء البحر يتم عادة عن طريق تبخير مياه البحر وتكثيف البخار. أي يتم هذا عن طريق إمداد ماء البحر الموجود في غلاية بطاقة حرارية من الخارج لإجراء التبخير. ويعطينا الضغط الأزموزي المعكوس طريقة ثانية لاستخلاص ماء عذب من ماء البحر (اقرأ محطة تناضح عكسي). أي تتفق الطريقتان في كونهما تحتاجان إلى طاقة خارجية لفصل الملح عن الماء ، وهذا ما تقوله قوانين الترموديناميكا .
محطة قوى بالضغط الأزموزي
 مقالة مفصلة: محطة قوى بالضغط الأزموزي
مقالة مفصلة: محطة قوى بالضغط الأزموزي
بنيت فكرة محطة القوى التي تعمل بالضغط الأزموزي علي استغلال الشغل الناتج من الضغط الأزموزي لإنتاج الطاقة . وتستغل محطة القوى الفرق في الكمون الكيميائي بين ماء البحر المحتوي على الملح والكمون الكيميائي للماء العذب ، وتشغيل عنفة يحرك مولد كهربائي لإنتاج التيار الكهربائي.
يمر ماء عذب في أنبوب عبارة عن غشاء نصف نافذ خلال ماء البحر فيرتفع الضغط في الماء المالح . ويوجه جزء من الماء ذو الضغط العالي ( وهو ماء نصف مالح حيث اكتسب جزءا من الماء العذب) ، يوجه إلى عنفة لإدارته ، بينما الجزء الأكبر من هذا الماء (2/3 الكمية) إلى مبادل للضغط يعمل على رفع ضغط ماء البحر المسحوب .[23]
وقد أنشئت محطات قوى تجريبية للعمل بهذه الطريقة بغرض دراستها وتحسينها ، ولكن لم تدخل حيز التطبيق الصناعي لإنتاج الطاقة . تصل قدرة المحطات التجريبية إلى نحو 3 ميجاوات وتعمل منذ عدة سنوات ويجرى تطويرها وتحسينها.[24] وقد شيدت أول محطة طاقة صغيرة في النرويج في خليج أوسلو في نوفمبر 2009 وتسمى محطة توليد الطاقة بـ«ستاتكرافت» (بالنرويجية: Statkraft Hurum saltkraftverk) وهي حاليًا أكبر محطة تستغل ضغط التناضح لإنتاج الكهرباء.[25]
المراجع
^ الهيئة الذرية السورية نسخة محفوظة 06 أغسطس 2017 على موقع واي باك مشين.
^ مكتب تنسيق التعريب، تاريخ الولوج 24 شباط 2015
^ ترجمة Osmosis حسب بنك باسم للمصطلحات العلمية؛ مدينة الملك عبد العزيز للعلوم والتقنية، تاريخ الوصول: 05 02 2017.
^ المعجم الطبي الموحد
^ معجم المصطلحات العلمية والفنية والهندسية الجديد
^ معجم مرعشي الطبي الكبير
↑ أبت قاموس المورد، البعلبكي، ببروت، لبنان
^ جامعة أم القرى نسخة محفوظة 17 مارس 2016 على موقع واي باك مشين.
^ ويب طب؛ تاريخ الولوج 23 فبراير 2015 نسخة محفوظة 16 أبريل 2015 على موقع واي باك مشين.
^ ترجمة Osmosis حسب بنك باسم للمصطلحات العلمية؛ مدينة الملك عبد العزيز للعلوم والتقنية، تاريخ الوصول: 05 02 2017.
^ كتاب العلوم الحياتية للصف التاسع، المملكة الاردنية الهاشمية، الجزء الأول، صفحة 57، طبعة عام 2011.
^ كتاب الأحياء للصف الحادي عشر، الجزء الأول، صفحة 41، دولة فلسطين. نسخة محفوظة 05 فبراير 2017 على موقع واي باك مشين.
^ كتاب الأحياء للصف الحادي عشر العلميص40، دولة الكويت[وصلة مكسورة]نسخة محفوظة 25 فبراير 2015 على موقع واي باك مشين.
^ كتاب الأحياء للصف الأول الثانوي، صفحة 108، دولة اليمن. نسخة محفوظة 22 أكتوبر 2017 على موقع واي باك مشين.
^ كتاب الأحياء للصف الأول الثانوي، صفحة 28، الجماهيرية الليبية.
↑ أب قاموس أطلس الحديث.
↑ أب المعجم الطبي
^ بنك باسم للمصطلحات، مجال علم الأحياء والطب البيطري نسخة محفوظة 02 مارس 2018 على موقع واي باك مشين.
^ مقرر فسيولوجيا النبات، د. محب طه صقر أستاذ فسيولوجيا النبات بكلية الزراعة بجامعة المنصورة.
^ كتاب المعلم لمادة الأحياء، الصف الحادي عشر، الجزء الأول، صفحة 6، فصل الاتزان الداخلي والنقل، دولة الإمارات العربية المتحدة[وصلة مكسورة]نسخة محفوظة 19 نوفمبر 2016 على موقع واي باك مشين.
^ كتاب الأحياء للصف الأول الثانوي، صفحة 26، الجماهيرية الليبية.
↑ أب بنك باسم للمصطلحات نسخة محفوظة 09 مارس 2018 على موقع واي باك مشين.
^ Statkraft: Osmotic Power (PDF, engl.)
^ Bericht der Financial Times Deutschland vom 23. Jan. 2008
^ Statkraft Pressemitteilung 24. Nov. 2009 (engl.) نسخة محفوظة 29 أبريل 2012 على موقع واي باك مشين.
انظر أيضاً
- تناضح عكسي
- تناضح كهربائي
- محطة تناضح عكسي
- انتشار
- توازن ترموديناميكي
- تحلية مياه البحر عن طريق طاقة الرياح
- محطة هوروم للتناضح العكسي
- توترية
- طاقة إسموزية
بوابة علم الأحياء
بوابة علم الأحياء الخلوي والجزيئي
بوابة الكيمياء
بوابة الفيزياء
|
تصنيفات:
- انتشار
- تقانة الأغشية
- تقنية المياه
- غشاء حيوي
- فيزياء حيوية
(window.RLQ=window.RLQ||[]).push(function()mw.config.set("wgPageParseReport":"limitreport":"cputime":"0.364","walltime":"0.643","ppvisitednodes":"value":1491,"limit":1000000,"ppgeneratednodes":"value":0,"limit":1500000,"postexpandincludesize":"value":22525,"limit":2097152,"templateargumentsize":"value":3316,"limit":2097152,"expansiondepth":"value":13,"limit":40,"expensivefunctioncount":"value":1,"limit":500,"unstrip-depth":"value":0,"limit":20,"unstrip-size":"value":15274,"limit":5000000,"entityaccesscount":"value":1,"limit":400,"timingprofile":["100.00% 350.551 1 -total"," 29.24% 102.512 1 قالب:شريط_بوابات"," 22.91% 80.319 1 قالب:مراجع"," 21.55% 75.542 1 قالب:تصنيف_كومنز"," 12.01% 42.112 3 قالب:رمز_لغة_واسمها"," 11.20% 39.249 1 قالب:يونانية"," 8.18% 28.680 3 قالب:اسم_لغة"," 8.15% 28.563 1 قالب:شقيقة"," 8.00% 28.050 1 قالب:ضبط_استنادي"," 7.56% 26.497 10 قالب:Webarchive"],"scribunto":"limitreport-timeusage":"value":"0.093","limit":"10.000","limitreport-memusage":"value":3258732,"limit":52428800,"cachereport":"origin":"mw1261","timestamp":"20190501194844","ttl":2592000,"transientcontent":false););"@context":"https://schema.org","@type":"Article","name":"u062eu0627u0635u064au0629 u0623u0633u0645u0648u0632u064au0629","url":"https://ar.wikipedia.org/wiki/%D8%AE%D8%A7%D8%B5%D9%8A%D8%A9_%D8%A3%D8%B3%D9%85%D9%88%D8%B2%D9%8A%D8%A9","sameAs":"http://www.wikidata.org/entity/Q54237","mainEntity":"http://www.wikidata.org/entity/Q54237","author":"@type":"Organization","name":"u0627u0644u0645u0633u0627u0647u0645u0648u0646 u0641u064a u0645u0634u0627u0631u064au0639 u0648u064au0643u064au0645u064au062fu064au0627","publisher":"@type":"Organization","name":"u0645u0624u0633u0633u0629 u0648u064au0643u064au0645u064au062fu064au0627","logo":"@type":"ImageObject","url":"https://www.wikimedia.org/static/images/wmf-hor-googpub.png","datePublished":"2007-02-21T17:39:53Z","image":"https://upload.wikimedia.org/wikipedia/commons/f/fe/Semipermeable_membrane_%28svg%29.svg"(window.RLQ=window.RLQ||[]).push(function()mw.config.set("wgBackendResponseTime":141,"wgHostname":"mw1272"););






















