დეზოქსირიბონუკლეინის მჟავა სექციების სია შესწავლის ისტორია მოლეკულის სტრუქტურა ბიოლოგიური ფუნქციები ურთიერთქმედება ცილებთან გენეტიკური რეკომბინაცია დნმ-ზე დამყარებული მეტაბოლიზმის ევოლუცია იხილეთ აგრეთვე ლიტერატურა რესურსები ინტერნეტში სქოლიო სანავიგაციო მენიუყველა ფორუმი > მ. პტაშნეს წიგნი „გენთა გადართვა“ორმაგი სპირალი: მოგონებები დნმ-ის სტრუქტურის აღმოჩენის შესახებ.DNA binding site prediction on proteinდნმ — ორმაგი სპირალის თამაშიდნმ ელექტრონული მიკროსკოპის ქვეშდნმ-ის შესწავლის ცენტრიორმაგი სპირალი: დნმ-ის 50 წელიწადიმეთოდებიმოლეკულურ-ბიოლოგიური ჟურნალების ვებმისამართებიმონაცემთა საერთაშორისო ბაზასენგეროვის ინსტიტუტის ვებსაიტიSoftware for forensic DNA Typing — eQMS::DNANo Nobel for You: Top 10 Nobel Snubs. Rosalind Franklin--her work on the structure of DNA never received a Nobelორიგინალიდან15680349"Independent functions of viral protein and nucleic acid in growth of bacteriophage"12981234"Molecular structure of nucleic acids; a structure for deoxyribose nucleic acid"The Nobel Prize in Physiology or Medicine 1962Н. Домрина В России есть кому делать науку — если будет на что // Журнал «Наука и жизнь», № 2, 2002Maxim Frank-Kamenetskii DNA structure: A simple solution to the stability of the double helix? // ჟურნალი Nature № 324, 305 (27 November 1986)Maxim Frank-Kamenetskii H-form DNA and the hairpin-triplex model // Журнал Nature № 333, 214 (19 May 1988)Molecular Biology of the Cell; Fourth EditionAbbreviations and Symbols for Nucleic Acids, Polynucleotides and their Constituents"Decoding the genome: a modified view"147159217526075"Mechanical stability of single DNA molecules"10733978"A more unified picture for the thermodynamics of nucleic acid duplex melting: a characterization by calorimetric and volumetric techniques"10393911Functions of DNA methylation: islands, start sites, gene bodies and beyondPDB 1JDG"Urinary 8-hydroxy-2′-deoxyguanosine as a biological marker of in vivo oxidative DNA damage""Thymine glycol and thymidine glycol in human and rat urine: a possible assay for oxidative DNA damage"160045651139541212042765NDB UD00173907856"The telomerase reverse transcriptase: components and regulation"9553037"Normal human chromosomes have long G-rich telomeric overhangs at one end"9353250"Quadruplex DNA: sequence, topology and structure"1701227610338214"The C-value enigma in plants and animals: a review of parallels and an appeal for partnership""The role of heterochromatin in centromere function""Molecular fossils in the human genome: identification and analysis of the pseudogenes in chromosomes 21 and 22""Molecular fossils in the human genome: identification and analysis of the pseudogenes in chromosomes 21 and 22"RNA world - the dark matter of evolutionary genomicsRNA world - the dark matter of evolutionary genomics"RNA regulation: a new genetics?""Replicative DNA polymerases"15853876"A global transcriptional regulatory role for c-Myc in Burkitt's lymphoma cells""Unraveling DNA helicases. Motif, structure, mechanism and function""Biology of DNA restriction""Polymerase structures and function: variations on a theme?""The reverse transcriptase of HIV-1: from enzymology to therapeutic intervention""Prebiotic chemistry and the origin of the RNA world"11360970"What is the optimum size for the genetic alphabet?"1372984
დნმგენეტიკარადიობიოლოგიარჩეული სტატიები
მაკრომოლეკულარნმცილებიცოცხალი ორგანიზმებისგენეტიკურიპროგრამისშენახვასინფორმაციასრნმცილებისქრომოსომებისევკარიოტებისცხოველებისმცენარეებისასოკოებისუჯრედებშიუჯრედის ბირთვშიქრომოსომისმიტოქონდრიებსაპლასტიდებშიპროკარიოტული ორგანიზმებისბაქტერიებისაარქეებისნუკლეოიდიუჯრედის მემბრანაზესაფუარებშიპლაზმიდებსვირუსებისგენომისპოლიმერულინუკლეოტიდებისგანაზოტოვანი ფუძისგანდეზოქსირიბოზისაფოსფატის ჯგუფისგანფოსფოდიეთერული ბმებიადენინიგუანინითიმინიციტოზინიწყალბადური ბმებითკომპლემენტარობის პრინციპისი-რნმრ-რნმტ-რნმტრანსკრიფციისტრანსლაციისგენომშიტრანსპოზონებს19531962ფრენსის კრიკსჯეიმზ უოტსონსამორის უილკინსსნობელის პრემია ფიზიოლოგიის ან მედიცინის დარგშიროზალინდ ფრანკლინი1958იოჰან ფრიდრიხ მიშერმა1868ქსოვილებისბირთვის1831ლეიკოციტებილეიკოციტებსღორისკუჭისმარილმჟავაპეპსინიბირთვისაზოტიფოსფორინივთიერებამჟავისფოსფორისXX საუკუნისინფორმაციისცილებიოსვალდ ევერის, კოლინ მაკ-ლეოდისა და მაკლინ მაკ-კარტის ექსპერიმენტებმა1944ბაქტერიებისტრანსფორმაციებზეპნევმოკოკებიდანჰერში — ჩეიზის ექსპერიმენტი1952რადიოაქტიური იზოტოპებითბაქტერიოფაგებისXX საუკუნის50-იანი წლებისნუკლეოტიდებისგანფრენსის კრიკმაჯეიმზ უოტსონმა1953მორის უილკინსისაროზალინდ ფრანკლინის„ჩარგაფის წესებზე“1962ნობელის პრემია ფიზიოლოგიის ან მედიცინის დარგშიროზალინდ ფრანკლინი1957ამერიკელებმა19851986მოსკოვშიბიოპოლიმერსპოლიანიონინუკლეოტიდიქრომოსომისფოსფორმჟავისშაქარდეზოქსირიბოზაზეაზოტოვანი ფუძიდანდეზოქსირიბოზანახშირბადისშაქარსპენტოზასატომებსფოსფოდიეთერული ბმითრნმრიბოზაფოსფატსაპურინებიადენინიგუანინიჰეტეროციკლებითპირიმიდინებიციტოზინითიმინიბაქტერიოფაგურაცილიპირიმიდინული ფუძეთიმინისგანსატრანსპორტორიბოსომულ რნმ-ებშიპოლიმერსნუკლეოტიდებიკოვალენტური ბმითწყალბადური ბმებისვირუსისაფოსფატებისაშაქრებისგანფოსფოდიეთერული ბმებითდეზოქსირიბოზის3'-ჰიდროქსილის (3'—ОН) ჯგუფისაწყალბადური ბმებითÅნმ-სტრანსკრიფციის ფაქტორებიკომპლემენტარობის პრინციპსპურინებიპირიმიდინებისადენინითიმინთანციტოზინიგუანინთანჰიდროფობური ურთიერთქმედებებისასტეკინგისდნმ-ის რეპლიკაციისაკოვალენტურიჰელიკაზისპრომოტორებშიხერხემლიანთანემატოდხერხემლიანებშიბაქტერიებშიადენინისკინეტოპლასტებშიურაცილისგლიკოზილირებასპრომოტორულძუძუმწოვრებშიX-ქრომოსომის ინაქტივაციისთვისამინო ჯგუფითიმინადმუტაციებისმუტაგენითმჟანგავიმაალკილირებელირადიაციაულტრაიისფერირენტგენული გამოსხივებათიმინისკოვალენტური ბმებისთავისუფალი რადიკალებიწყალბადის პეროქსიდირეპარირებენქრომოსომებისდელეციატრანსლოკაციისინტერკალირდებაეთიდიუმსდაუნორუბიცინსთალიდომიდსარომატულიტრანსკრიფციასარეპლიკაციასკანცეროგენებსბენზპირენიაკრიდინებიაფლატოქსინიეთიდიუმის ბრომიდიკიბოსზესპირალიზაციისტოპოიზომერაზებითტრანსკრიფციისარეპლიკაციისქრომოსომებისტელომერებიეგზონუკლეაზებისგანრეპლიცირებატელომერაზაG-კვადრუპლექსებილითონისკალიუმისიონისჰელატირებითინგლ.გენეტიკური კოდისნუკლეოტიდებისმემკვიდრეობითობაცვალებადობარეპლიკაციისგაყოფის დროსუჯრედებირეალიზდებაგენებისტრანსკრიპციისატრანსლაციისრნმცილებისი-რნმრ-რნმტ-რნმტრანსკრიფციისტრანსლაციისცილაშიამინომჟავებისრიბოსომებისეუკარიოტებივირუსიბაქტერიებისპროკარიოტებიქლოროპლასტებიმიტოქონდრიებივირუსსაბაქტერიოფაგსლათ.ბირთვშიქრომოსომათაციტოპლაზმაშინუკლეოიდშიაღია წაკითხვის ჩარჩოსპრომოტორსაენჰანსერსსახეობაშიგენომისეგზონებისგანდნმ-ის არაკოდირებადი გამეორებადი თანმიმდევრობებისგანინგლ.ტელომერებიცენტრომერებიმუტაციებისწიაღისეულებისდუპლიკაციასადივერგენციაშიალტერნატიულ სპლაისინგშირნმმცირე ბირთვული რნმ-ისბიოპოლიმერისრნმტრანსკრიფციისი-რნმამინომჟავებსტრანსლაციისგენეტიკური კოდიკოდონებირნმ-პოლიმერაზისრიბოსომასატრანსპორტო რნმ-ებთანუჯრედების გაყოფაერთუჯრედიანირეპლიკაციისკომპლემენტარულიდნმ-პოლიმერაზასპრაიმერსპრაიმაზამუტაციარეპარაციულიფერმენტებსრნმ-პოლიმერაზებიტრანსკრიფციისრეპლიკაციისქრომატინიჰისტონებისპროკარიოტებისნუკლეოსომასიონური ბმებისტრანსკრიფციის ფაქტორებისთვისტრანსკრიფციისრეპლიკაციურირეპლიკაციისრეკომბინაციისარეპარაციისნუკლეაზებისტრანსკრიფციის ფაქტორებისტრანსკრიფციასპრომოტორშირნმ-პოლიმერაზასთანფერმენტებთანჰისტონებსგენომისუჯრედების დიფერენცირებისაზესპირალიზებულტოპოიზომერაზებინუკლეაზურილიგაზურირეპლიკაციატრანსკრიფციაჰელიკაზებინუკლეოტიდტრიფოსფატებისატფ-ისწყალბადური ბმებირეკომბინაციასარეპარაციაშიეგზონუკლეაზებიმულეკულურ ბიოლოგიასაგენურ ინჟინერიაშინუკლეაზებიარესტრიქციის ენდონუკლეაზებიბაქტერიებსბაქტერიოფაგებისგანმოდიფიკაცია-რესტრიქციის სისტემისდნმ-ლიგაზებიატფ-ისკლონირებასაფინგერპრინტინგშიმეტაბოლიზმისთვისნუკლეოზიდტრიფოსფატებიდანდნმ-პოლიმერაზებიჰიდროქსილის ჯგუფსკომპლემენტარულდნმ-ის რეპლიკაციისდნმ-ზე დამოკიდებული დნმ-პოლიმერაზამუტაციებსეგზონუკლეაზური აქტივობარეპლისომაჰელიკაზებსრნმ-ზე დამოკიდებული დნმ-პოლიმერაზებივირუსულიუკუტრანსკრიპტაზარეტროვირუსებიტელომერაზატელომერებისდნმ-ზე დამოკიდებული რნმ-პოლიმერაზითი-რნმ-ზეპრომოტორიტერმინატორამდექრომოსომაფერმენტებისბუნებრივი გადარჩევისრეპარაციაშირეკომბინაციაინფორმაციის შემცველიტრანსპოზონებიტრანსლოკაციებიაკატალიზირებენკომპლემენტარული ჯაჭვისგანქრომატიდისჰოლიდეის სტრუქტურანივთიერებათა ცვლაშირნმკატალიზისრიბოსომებისრეპლიკაციის16S რ-რნმ
(function()var node=document.getElementById("mw-dismissablenotice-anonplace");if(node)node.outerHTML="u003Cdiv class="mw-dismissable-notice"u003Eu003Cdiv class="mw-dismissable-notice-close"u003E[u003Ca tabindex="0" role="button"u003Eდამალვაu003C/au003E]u003C/divu003Eu003Cdiv class="mw-dismissable-notice-body"u003Eu003Cdiv id="localNotice" lang="ka" dir="ltr"u003Eu003Cdiv class="layout plainlinks" align="center"u003Eდაუკავშირდით ქართულ ვიკიპედიას u003Ca href="https://www.facebook.com/georgianwikipedia" rel="nofollow"u003Eu003Cimg alt="Facebook icon.svg" src="//upload.wikimedia.org/wikipedia/commons/thumb/1/1b/Facebook_icon.svg/14px-Facebook_icon.svg.png" decoding="async" width="14" height="14" srcset="//upload.wikimedia.org/wikipedia/commons/thumb/1/1b/Facebook_icon.svg/21px-Facebook_icon.svg.png 1.5x, //upload.wikimedia.org/wikipedia/commons/thumb/1/1b/Facebook_icon.svg/28px-Facebook_icon.svg.png 2x" data-file-width="256" data-file-height="256" /u003Eu003C/au003E u003Cbu003Eu003Ca rel="nofollow" class="external text" href="https://www.facebook.com/georgianwikipedia"u003EFacebooku003C/au003Eu003C/bu003E-ის ოფიციალურ გვერდზე!nu003Cpu003Eu003Cbr /u003Enu003C/pu003Enu003Ctable class="messagebox standard-talk" style="font-size:100%; text-align:center; border:3px solid blue; background-color:white;"u003Enu003Ctbodyu003Eu003Ctru003Enu003Ctdu003Eu003Ca href="/wiki/%E1%83%95%E1%83%98%E1%83%99%E1%83%98%E1%83%9E%E1%83%94%E1%83%93%E1%83%98%E1%83%90:%E1%83%94%E1%83%A0%E1%83%9D%E1%83%95%E1%83%9C%E1%83%A3%E1%83%9A%E1%83%98_%E1%83%9B%E1%83%9C%E1%83%98%E1%83%A8%E1%83%95%E1%83%9C%E1%83%94%E1%83%9A%E1%83%9D%E1%83%91%E1%83%98%E1%83%A1_%E1%83%99%E1%83%90%E1%83%A2%E1%83%94%E1%83%92%E1%83%9D%E1%83%A0%E1%83%98%E1%83%98%E1%83%A1_%E1%83%99%E1%83%A3%E1%83%9A%E1%83%A2%E1%83%A3%E1%83%A0%E1%83%98%E1%83%A1_%E1%83%A3%E1%83%AB%E1%83%A0%E1%83%90%E1%83%95%E1%83%98_%E1%83%AB%E1%83%94%E1%83%92%E1%83%9A%E1%83%94%E1%83%91%E1%83%98" title="ვიკიპედია:ეროვნული მნიშვნელობის კატეგორიის კულტურის უძრავი ძეგლები"u003Eu003Cimg alt="Khevi, Georgia — View of Gergeti Trinity Church.jpg" src="//upload.wikimedia.org/wikipedia/commons/thumb/5/5f/Khevi%2C_Georgia_%E2%80%94_View_of_Gergeti_Trinity_Church.jpg/100px-Khevi%2C_Georgia_%E2%80%94_View_of_Gergeti_Trinity_Church.jpg" decoding="async" width="100" height="57" srcset="//upload.wikimedia.org/wikipedia/commons/thumb/5/5f/Khevi%2C_Georgia_%E2%80%94_View_of_Gergeti_Trinity_Church.jpg/150px-Khevi%2C_Georgia_%E2%80%94_View_of_Gergeti_Trinity_Church.jpg 1.5x, //upload.wikimedia.org/wikipedia/commons/thumb/5/5f/Khevi%2C_Georgia_%E2%80%94_View_of_Gergeti_Trinity_Church.jpg/200px-Khevi%2C_Georgia_%E2%80%94_View_of_Gergeti_Trinity_Church.jpg 2x" data-file-width="900" data-file-height="510" /u003Eu003C/au003Enu003C/tdu003Enu003Ctd width="100%"u003Eu003Cbigu003Eu003Cbigu003E u003Cbu003Eu003Ca href="/wiki/%E1%83%95%E1%83%98%E1%83%99%E1%83%98%E1%83%9E%E1%83%94%E1%83%93%E1%83%98%E1%83%90:%E1%83%94%E1%83%A0%E1%83%9D%E1%83%95%E1%83%9C%E1%83%A3%E1%83%9A%E1%83%98_%E1%83%9B%E1%83%9C%E1%83%98%E1%83%A8%E1%83%95%E1%83%9C%E1%83%94%E1%83%9A%E1%83%9D%E1%83%91%E1%83%98%E1%83%A1_%E1%83%99%E1%83%90%E1%83%A2%E1%83%94%E1%83%92%E1%83%9D%E1%83%A0%E1%83%98%E1%83%98%E1%83%A1_%E1%83%99%E1%83%A3%E1%83%9A%E1%83%A2%E1%83%A3%E1%83%A0%E1%83%98%E1%83%A1_%E1%83%A3%E1%83%AB%E1%83%A0%E1%83%90%E1%83%95%E1%83%98_%E1%83%AB%E1%83%94%E1%83%92%E1%83%9A%E1%83%94%E1%83%91%E1%83%98" title="ვიკიპედია:ეროვნული მნიშვნელობის კატეგორიის კულტურის უძრავი ძეგლები"u003Eეროვნული მნიშვნელობის კატეგორიის კულტურის უძრავი ძეგლებისu003C/au003E კონკურსი დაიწყო! ჩაერთეთ და მოიგეთ პრიზები!u003C/bu003Eu003C/bigu003Eu003C/bigu003Enu003C/tdu003Eu003C/tru003Eu003C/tbodyu003Eu003C/tableu003Enu003C/divu003Eu003C/divu003Eu003C/divu003Eu003C/divu003E";());
დეზოქსირიბონუკლეინის მჟავა
Jump to navigation
Jump to search

დნმ-ის ორმაგი სპირალი
დეზოქსირიბონუკლეინის მჟავა (დნმ) — მაკრომოლეკულა (სამი ძირითადიდან ერთ-ერთი, დანარჩენი ორი — რნმ და ცილები), რომელიც უზრუნველყოფს ცოცხალი ორგანიზმების განვითარებისა და ფუნქციონირების გენეტიკური პროგრამის შენახვას, თაობიდან თაობაზე გადაცემასა და რეალიზებას. დნმ შეიცავს ინფორმაციას რნმ-ისა და ცილების სხვადასხვა ტიპის სტრუქტურების შესახებ. იგი ცოცხალი ორგანიზმის გენეტიკური მასალის — ქრომოსომების ძირითადი შემადგენელი ნაწილია.
ევკარიოტების (ცხოველების, მცენარეებისა და სოკოების) უჯრედებში დნმ მდებარეობს უჯრედის ბირთვში, ქრომოსომის შემადგენლობაში, აგრეთვე ზოგიერთ უჯრედულ ორგანოიდში (მიტოქონდრიებსა და პლასტიდებში). პროკარიოტული ორგანიზმების (ბაქტერიებისა და არქეების) უჯრედებში დნმ-ის რგოლოვანი ან ხაზოვანი მოლეკულა, ეგრეთ წოდებული ნუკლეოიდი, შიგნიდან არის მიმაგრებული უჯრედის მემბრანაზე. პროკარიოტებსა და უმდაბლეს ევკარიოტებში (მაგალითად, საფუარებში) გვხვდება აგრეთვე დნმ-ის მცირე ავტონომური, უმეტესწილად რგოლოვანი მოლეკულები, რომლებსაც პლაზმიდებს უწოდებენ. გარდა ამისა, დნმ-ის ერთ- ან ორჯაჭვიან მოლეკულებს შეუძლიათ დნმ-ის შემცველი ვირუსების გენომის წარმოქმნა.
ქიმიური თვალსაზრისით, დნმ — ეს არის გრძელი პოლიმერული მოლეკულა, რომელიც შედგება გამეორებადი ბლოკების — ნუკლეოტიდებისგან. თითოეული ნუკლეოტიდი შედგება აზოტოვანი ფუძისგან, შაქრისა (დეზოქსირიბოზისა) და ფოსფატის ჯგუფისგან. ჯაჭვში ნუკლეოტიდებს შორის ბმა წარმოიქმნება დეზოქსირიბოზასა და ფოსფატის ჯგუფის ხარჯზე (ფოსფოდიეთერული ბმები). უმეტეს შემთხვევაში (გარდა ზოგიერთი ვირუსისა, რომლებიც შეიცავენ ერთჯაჭვიან დნმ-ს) დნმ-ის მაკრომოლეკულა შედგება ორი ჯაჭვისგან, რომლებიც ერთმანეთზე აზოტოვანი ფუძეების მეშვეობით ორიენტირებენ. ეს ორჯაჭვიანი მოლეკულა სპირალიზებულია. მთლიანობაში დნმ-ის მოლეკულის სტრუქტურამ მიიღო „ორმაგი სპირალის“ სახელწოდება.
დნმ-ში გვხვდება აზოტოვანი ფუძეების ოთხი სახე (ადენინი, გუანინი, თიმინი და ციტოზინი). ერთ-ერთი ჯაჭვის აზოტოვანი ფუძეები მეორე ჯაჭვის აზოტოვან ფუძეებთან დაკავშირებულია წყალბადური ბმებით, კომპლემენტარობის პრინციპის მიხედვით: ადენინი უკავშირდება მხოლოდ თიმინს, გუანინი — მხოლოდ ციტოზინს. ნუკლეოტიდების თანმიმდევრობა იძლევა სხვადასხვა ტიპის რნმ-ის შესახებ ინფორმაციის „კოდირების“ საშუალებას. რნმ-ებს შორის ყველაზე მნიშვნელოვანია ინფორმაციული, ანუ მატრიცული (ი-რნმ), რიბოსომული (რ-რნმ) და სატრანსპორტო (ტ-რნმ) რნმ-ები. რნმ-ის ყველა ეს ტიპი სინთეზირდება დნმ-ის მატრიცაზე, დნმ-ის თანმიმდევრობის რნმ-ის თანმიმდევრობაზე კოპირების ხარჯზე, ეს უკანასკნელი კი სინთეზირდება ტრანსკრიფციის დროს და მონაწილეობას იღებს ცილების ბიოსინთეზში (ტრანსლაციის დროს). მაკოდირებელი თანმიმდევრობების გარდა, უჯრედების დნმ შეიცავს აგრეთვე თანმიმდევრობებს, რომლებიც ასრულებენ მარეგულირებელ და სტრუქტურულ ფუნქციებს. გარდა ამისა, ევკარიოტების გენომში ხშირად გვხვდება უბნები, რომლებიც განეკუთვნებიან „გენეტიკურ პარაზიტებს“, მაგალითად, ტრანსპოზონებს.
დნმ-ის სტრუქტურის გაშიფვრა (1953 წელი) ბიოლოგიის ისტორიაში ერთ-ერთი გარდამტეხი მომენტი გახდა. ამ აღმოჩენაში შეტანილი მნიშვნელოვანი წვლილისთვის 1962 წელს ფრენსის კრიკს, ჯეიმზ უოტსონსა და მორის უილკინსს გადაეცათ ნობელის პრემია ფიზიოლოგიის ან მედიცინის დარგში. როზალინდ ფრანკლინი, რომელმაც მიიღო რენტგენოგრამები, რომელთა გარეშეც უოტსონი და კრიკი ვერ შეძლებდნენ დნმ-ის სტრუქტურის შესახებ დასკვნების გაკეთებას, კიბოსგან გარდაიცვალა 1958 წელს, ნობელის პრემიას კი სიკვდილის შემდგომ არ გასცემენ.[1]
სექციების სია
1 შესწავლის ისტორია
2 მოლეკულის სტრუქტურა
2.1 ნუკლეოტიდები
2.2 ორმაგი სპირალი
2.3 ფუძეებს შორის კავშირის წარმოქმნა
2.4 ფუძეების ქიმიური მოდიფიკაციები
2.5 დნმ-ის დაზიანება
2.6 ზესპირალიზაცია
2.7 სტრუქტურები ქრომოსომათა ბოლოებზე
3 ბიოლოგიური ფუნქციები
3.1 გენომის სტრუქტურა
3.2 გენომის წყობები, რომლებიც არ აკოდირებენ ცილებს
3.3 ტრანსკრიფცია და ტრანსლაცია
3.4 რეპლიკაცია
4 ურთიერთქმედება ცილებთან
4.1 სტრუქტურული და მარეგულირებელი ცილები
4.2 დნმ-ის მამოდიფიცირებელი ფერმენტები
4.2.1 ტოპოიზომერაზები და ჰელიკაზები
4.2.2 ნუკლეაზები და ლიგაზები
4.2.3 პოლიმერაზები
5 გენეტიკური რეკომბინაცია
6 დნმ-ზე დამყარებული მეტაბოლიზმის ევოლუცია
7 იხილეთ აგრეთვე
8 ლიტერატურა
9 რესურსები ინტერნეტში
10 სქოლიო
შესწავლის ისტორია

ფრენსის კრიკი

ჯეიმზ უოტსონი
დნმ აღმოაჩინა შვეიცარიელმა ექიმმა, იოჰან ფრიდრიხ მიშერმა 1868 წელს. მან არც კი იცოდა, ამ აღმოჩენით რა გადატრიალებას ჩაუყარა საფუძველი ბიოლოგიაში. მიშერი სრულიადაც არ ეძებდა მემკვიდრეულ ნივთიერებას, იგი ჰისტოქიმიით იყო გატაცებული. ფრიდრიხ მიშერი ღრმად იყო დარწმუნებული, რომ ქსოვილების განსხვავებულ აგებულებასა და ფუნქციებს მათი განსხვავებული ქიმიური შედგენილობა განაპირობებდა. მას განსაკუთრებით ბირთვის კვლევა აინტერესებდა, რადგან მიუხედავად იმისა, რომ ბირთვი 1831 წელს აღმოაჩინეს, მისი ქიმიური ბუნების შესახებ არაფერი იყო ცნობილი. საკვლევ მასალად მიშერმა ჩირქი აიღო, რადგანაც ჩირქში არსებული ლეიკოციტები მშვენიერ საკვლევ ობიექტს წარმოადგენდა, უჯრედების მარტივი აგებულების გამო. გარდა ამისა, საკვლევი მასალის მოპოვების თვალსაზრისით, მას პრობლემა არ ჰქონდა — ქირურგიული კლინიკა მას ყოველდღე ამარაგებდა დოლბანდით, რომლითაც ოპერაციების შემდეგ ავადმყოფებს ჭრილობებს უხვევდნენ. ბირთვების გამოსაყოფად მიშერი ლეიკოციტებს ღორის კუჭის წვენით ამუშავებდა. კუჭის წვენი და მარილმჟავა პეპსინი, ბირთვის გარდა, პრაქტიკულად მთლიანად შლიდა ლეიკოციტის უჯრედს. ჩირქში არსებული უჯრედების ნარჩენებისგან მან გამოყო ნივთიერება, რომლის შემადგენლობაშიც შედის აზოტი და ფოსფორი. თავდაპირველად ახალმა ნივთიერებამ მიიღო სახელწოდება ნუკლეინი, ხოლო მოგვიანებით, როდესაც მიშერმა განსაზღვრა, რომ ეს ნივთიერება ფლობდა მჟავის თვისებებს, ნივთიერებამ მიიღო სახელწოდება ნუკლეინის მჟავა.[2] ახალაღმოჩენილი ნივთიერების ბიოლოგიური ფუნქცია გაურკვეველი იყო და დიდი ხნის განმავლობაში დნმ ითვლებოდა ორგანიზმში ფოსფორის სათადარიგო მარაგად. უფრო მეტიც, XX საუკუნის დასაწყისში ბევრი ბიოლოგი მიიჩნევდა, რომ დნმ-ს არავითარი კავშირი არ ჰქონდა ინფორმაციის გადაცემასთან, რადგან მოლეკულის აგებულება, მათი აზრით, იყო ძალიან ერთფეროვანი და არ შეეძლო დაშიფრული ინფორმაციის ტარება.
დროთა განმავლობაში დამტკიცდა, რომ სწორედ დნმ, და არა ცილები, როგორც ძველად ითვლებოდა, იყო გენეტიკური ინფორმაციის მატარებელი. ერთ-ერთი უპირველესი გადამწყვეტი მტკიცებულებები მოიტანა ოსვალდ ევერის, კოლინ მაკ-ლეოდისა და მაკლინ მაკ-კარტის ექსპერიმენტებმა (1944 წელი) ბაქტერიების ტრანსფორმაციებზე. მათ მოახერხეს იმის დამტკიცება, რომ ეგრეთ წოდებულ ტრანსფორმაციაზე (უვნებელი კულტურის მიერ მასში დაავადების გამომწვევი მკვდარი ბაქტერიების დამატების შედეგად დაავადების გამომწვევი თვისებების შეძენა) პასუხისმგებელია პნევმოკოკებიდან გამოყოფილი დნმ. ამერიკელი მეცნიერების, ალფრედ ჰერშისა და მართა ჩეიზის მიერ (ჰერში — ჩეიზის ექსპერიმენტი, 1952 წელი) რადიოაქტიური იზოტოპებით მონიშნულ ცილებსა და ბაქტერიოფაგების დნმ-ზე ჩატარებულმა ექსპერიმენტმა აჩვენა, რომ ინფიცირებულ უჯრედს გადაეცემა ფაგის მხოლოდ ნუკლეინის მჟავა, ხოლო ფაგის ახალი თაობა შეიცავს ისეთივე ცილებსა და ნუკლეინის მჟავას, როგორსაც საწყისი ფაგი.[3]
XX საუკუნის 50-იანი წლების ჩათვლით დნმ-ის ზუსტი აგებულება, ისევე, როგორც მემკვიდრული ინფორმაციის გადაცემის ხერხი, უცნობი იყო. მიუხედავად იმისა, რომ ცნობილი იყო ის ფაქტი, რომ დნმ შედგებოდა რამდენიმე ჯაჭვისგან, რომლებიც თავის მხრივ შედგებოდნენ ნუკლეოტიდებისგან, ზუსტად არავინ იცოდა, სულ რამდენი ჯაჭვი იყო დნმ-ში და როგორ უკავშირდებოდა ისინი ერთმანეთს.
დნმ-ის ორმაგი სპირალის სტრუქტურა შემოგვთავაზეს ფრენსის კრიკმა და ჯეიმზ უოტსონმა 1953 წელს, მორის უილკინსისა და როზალინდ ფრანკლინის მიერ მიღებულ რენტგენოსტრუქტურულ მონაცემებსა და „ჩარგაფის წესებზე“ დაყრდნობით, რომელთა თანახმადაც, დნმ-ის თითოეულ მოლეკულაში დაცულია მკაცრი ურთიერთკავშირები, რომლებიც ერთმანეთთან აკავშირებს სხვადასხვა ტიპის აზოტოვანი ფუძეების რაოდენობას[4]. მოგვიანებით უოტსონისა და კრიკის მიერ შემოთავაზებული დნმ-ის მოდელი დამტკიცდა, მათმა ნამუშევარმა კი 1962 წელს მიიღო ნობელის პრემია ფიზიოლოგიის ან მედიცინის დარგში. ლაურეატებს შორის არ იყო იმ დროისთვის უკვე კიბოთი გარდაცვლილი როზალინდ ფრანკლინი, რადგან პრემია არ გაიცემა გარდაცვალების შემდეგ.[5]
საინტერესოა, რომ 1957 წელს ამერიკელებმა ალექსანდერ რიჩმა, გერი ფელზენფელდმა და დეივიდ დეივისმა აღწერეს ნუკლეინის მჟავა, რომელიც შედგებოდა სამი სპირალისგან.[6] ხოლო 1985-1986 წლებში მაქსიმ ფრანკ-კამენეცკიმ მოსკოვში აჩვენა, რომ ორმაგი სპირალის მქონე დნმ ლაგდება ეგრეთ წოდებულ H-ფორმად, რომელიც შედგება დნმ-ის უკვე არა ორი, არამედ სამი ძაფისგან.[7][8]
მოლეკულის სტრუქტურა
ნუკლეოტიდები
 |  |  |  |
ადენინი | გუანინი | თიმინი | ციტოზინი |
დეზოქსირიბონუკლეინის მჟავა (დნმ) წარმოადგენს ბიოპოლიმერს (პოლიანიონი), რომლის მონომერიც არის ნუკლეოტიდი.[9][10] როგორც წესი, იგი ძალიან გრძელია. მაგალითად, ადამიანის უდიდესი ქრომოსომის დნმ მიმდევრობით შეერთებული 220 მილიონი ნუკლეოტიდისაგან შედგება.
თითოეული ნუკლეოტიდი შედგება ფოსფორმჟავის ნაშთისგან, რომელიც 5'-მდგომარეობითაა მიმაგრებული შაქარ დეზოქსირიბოზაზე, რომელზეც გლიკოზიდური ბმით (C—N) 1'-მდგომარეობით აგრეთვე დაკავშირებულია ოთხი აზოტოვანი ფუძიდან ერთ-ერთი. თითოეულ ნუკლეოტიდში შემავალი დეზოქსირიბოზა ნახშირბადის ხუთი ატომის შემცველ შაქარს, ანუ პენტოზას წარმოადგენს. დნმ-ის ჯაჭვის „ხერხემალი“ მეზობელი დეზოქსირიბოზების მესამე და მეხუთე ნახშირბადის ატომებს შორის წარმოქმნილი ფოსფოდიეთერული ბმით არის შეკავშირებული. ამ ბმის ასიმეტრიულობა იწვევს იმას, რომ დნმ-ის ჯაჭვის ბოლოები ერთმანეთისგან განსხვავდება: ჯაჭვის ერთ ბოლოზე თავისუფალია ბოლო პენტოზის მესამე ნახშირბად-ატომი (დნმ-ჯაჭვის ამ ბოლოს ეწოდება 3'-ბოლო), ხოლო ჯაჭვის მეორე ბოლოზე კი — ბოლო პენტოზის მეხუთე ნახშირბად-ატომი (ამ ბოლოს 5'-ბოლო ეწოდება). ეს ნიშნავს რომ, შესაძლებელია დნმ-ის ჯაჭვის მიმართულების გარჩევა. სწორედ სახასიათო შაქრის არსებობა წარმოადგენს ერთ-ერთ უმთავრეს სხვაობას დნმ-სა და რნმ-ს შორის და დაფიქსირებულია ამ ნუკლეინის მჟავების სახელწოდებებში (რნმ-ის შემადგენლობაში შედის შაქარი რიბოზა).[11] ნუკლეოტიდის მაგალითია ადენოზინმონოფოსფატი, რომლის ფუძესაც, რომელიც დაკავშირებულია ფოსფატსა და რიბოზასთან, წარმოადგენს ადენინი (ნაჩვენებია სურათზე).
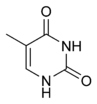
მოლეკულების სტრუქტურიდან გამომდინარე, ნუკლეოტიდების შემადგენლობაში შემავალ ფუძეებს ყოფენ ორ ჯგუფად: პურინები (ადენინი [A] და გუანინი [G]) წარმოქმნილია შეერთებული ხუთ- ან ექვსწევრიანი ჰეტეროციკლებით; პირიმიდინები (ციტოზინი [C] და თიმინი [T]) — ექვსწევრიანი ჰეტეროციკლით.[12]
გამონაკლისის სახით, მაგალითად, ბაქტერიოფაგ PBS1-ის დნმ-ში გვხვდება ფუძეების მეხუთე ტიპი — ურაცილი ([U]), პირიმიდინული ფუძე, რომელიც თიმინისგან განსხვავდება იმით, რომ მას ჯაჭვში არ აქვს მეთილის ჯგუფი. რნმ-ში იგი, როგორც წესი, თიმინს ანაცვლებს.[13]
აღსანიშნავია, რომ თიმინი და ურაცილი არც ისე მკაცრად არიან გამიჯნულნი დნმ-სა და რნმ-თან შესაბამისად, როგორც მანამდე ითვლებოდა. ამგვარად, რნმ-ის ზოგიერთი მოლეკულის სინთეზის შემდეგ ამ მოლეკულებში ურაცილების მნიშვნელოვანი რაოდენობა მეთილირდება სპეციალური ფერმენტების დახმარებით და გარდაიქმნება თიმინად. ეს მიმდინარეობს სატრანსპორტო და რიბოსომულ რნმ-ებში.[14]
ორმაგი სპირალი

მოლეკულის ნუკლეოტიდური შემადგენლობისა და იონების კონცენტრაციის მიხედვით, დნმ-ის ორმაგი სპირალი ცოცხალ ორგანიზმებში სხვადასხვა ფორმებად არსებობს. სურათზე წარმოდგენილია A, B და Z ფორმები (მარცხნიდან მარჯვნივ)
დნმ-ის პოლიმერს საკმაოდ რთული სტრუქტურა აქვს. ნუკლეოტიდები ერთმანეთთან დაკავშირებულია კოვალენტური ბმით და ქმნის გრძელ პოლინუკლეოტიდურ ჯაჭვებს. ეს ჯაჭვები წყალბადური ბმების დახმარებით უმეტესწილად წყვილ-წყვილად (გარდა ზოგიერთი ვირუსისა, რომლებსაც აქვთ ერთჯაჭვიანი დნმ-გენომები) ერთიანდება მეორეულ სტრუქტურაში, რომელმაც მიიღო ორმაგი სპირალის სახელწოდება.[4][11] თითოეული ჯაჭვის ჩონჩხი შედგება ერთმანეთის მონაცვლე ფოსფატებისა და შაქრებისგან.[15] დნმ-ის ერთი ჯაჭვის შიგნით მეზობელი ნუკლეოტიდები დაკავშირებულია ფოსფოდიეთერული ბმებით, რომლებიც იქმნება ერთი ნუკლეოტიდის დეზოქსირიბოზის მოლეკულის 3'-ჰიდროქსილის (3'—ОН) ჯგუფისა და მეორე ნუკლეოტიდის 5'-ფოსფატის ჯგუფის (5'—РО3) ერთმანეთში ურთიერთქმედების შედეგად. დნმ-ის ჯაჭვის ასიმეტრიულ ბოლოებს ეწოდებათ 3' (სამი პრიმი) და 5' (ხუთი პრიმი). ჯაჭვის პოლარულობა მნიშვნელოვან როლს თამაშობს დნმ-ის სინთეზის დროს (ჯაჭვის დაგრძელება შესაძლებელია მხოლოდ თავისუფალ 3'-ბოლოზე ახალი ნუკლეოტიდების მიერთების გზით).
როგორც უკვე ითქვა, ცოცხალი ორგანიზმების უმრავლესობის დნმ შედგება არა ერთი, არამედ ორი პოლინუკლეოტიდური ჯაჭვისგან. ეს ორი გრძელი ჯაჭვი დახვეულია ერთი მეორის გარშემო ორგამი სპირალის სახით, რომელიც სტაბილიზებულია წყალბადური ბმებით, რომლებიც წარმოქმნილია მასში შემავალ ჯაჭვებში ერთმანეთისკენ მიმართულ აზოტოვან ფუძეებს შორის. ბუნებაში ეს სპირალი ძირითადად მარჯვნივ არის დახვეული. მიმართულებები ორ ჯაჭვში, რომელთაგანაც შედგება დნმ-ის მოლეკულა, 3'-ბოლოდან 5'-ბოლოსკენ საპირისპიროა (ჯაჭვები ერთმანეთის „ანტიპარალელურია“).
ორმაგი სპირალის სიგანე შეადგენს 22-დან 24 Å-ს, ან 2,2 — 2,4 ნმ-ს, თითოეული ნუკლეოტიდის სიგრძეა 3,3 Å (0,33 ნმ).[16] მსგავსად იმისა, თუ როგორ არის შესაძლებელი ხვეულ კიბეზე გვერდიდან საფეხურების დანახვა, ასევეა შესაძლებელი დნმ-ის ორმაგ სპირალში მოლეკულის ფოსფატის „ხერხემალზე“ შუალედებს შორის ფუძეების კიდეების დანახვა, რომელთა რგოლებიც მდებარეობს სიბრტყეზე, რომელიც პერპენდიკულარულია მაკრომოლეკულის განივი ღერძის მიმართ.
ორმაგ სპირალში განასხვავებენ მცირე (12 Å) და დიდ (22 Å) ღარებს.[17] ცილები, მაგალითად, ტრანსკრიფციის ფაქტორები, რომლებიც უერთდებიან ორჯაჭვიანი დნმ-ის განსაზღვრულ თანმიმდევრობას, ჩვეულებრივ, ურთიერთქმედებენ დიდ ღარში მდებარე ფუძეების ბოლოებთან, სადაც ისინი უფრო მეტად ხელმისაწვდომია.[18]
ფუძეებს შორის კავშირის წარმოქმნა

დნმ-ის ორი ჯაჭვი ერთმანეთთან აზოტოვან ფუძეებს შორის არსებული წყალბადური ბმებით (H-ბმა) არის შეკავშირებული.
ერთ-ერთი ჯაჭვის ყოველი ფუძე უკავშირდება მეორე ჯაჭვის ერთ კონკრეტულ ფუძეს. ამგვარ სპეციფიკურ კავშირს უწოდებენ კომპლემენტარობის პრინციპს. პურინები არიან პირიმიდინების კომპლემენტარულები (ანუ შეუძლიათ მათთან წყალბადური ბმების წარმოქმნა): ადენინი ბმას წარმოქმნის მხოლოდ თიმინთან, ხოლო ციტოზინი — მხოლოდ გუანინთან. ორმაგ სპირალში ჯაჭვები აგრეთვე დაკავშირებულია ჰიდროფობური ურთიერთქმედებებისა და სტეკინგის მეშვეობით, რომლებიც არ არიან დამოკიდებულნი დნმ-ის ფუძეების თანმიმდევრობაზე.[19]
ორმაგი სპირალის კომპლემენტარობა გულისხმობს, რომ ერთ ჯაჭვში არსებულ ინფორმაციას მეორე ჯაჭვიც შეიცავს. ცოცხალ ორგანიზმებში ფუძეების კომპლემენტარულ წყვილებს შორის ურთიერთქმედებების უკუქცევა და სპეციფიკურობა მნიშვნელოვანია დნმ-ის რეპლიკაციისა და მისი ყველა სხვა ფუნქციისათვის.
იქიდან გამომდინარე, რომ ბმები არ არის კოვალენტური, ისინი ადვილად წყდება და აღდგება. ფერმენტების (ჰელიკაზის) მოქმედებით ან მაღალი ტემპერატურის პირობებში ორმაგი სპირალის ჯაჭვები ერთმანეთს შორდება შესაკრავი ელვის მსგავსად.[20] ფუძეების სხვადასხვა წყვილები წარმოქმნიან სხვადასხვა რაოდენობის წყალბადურ ბმებს. ადენინი-თიმინი დაკავშირებულია ორი, ხოლო გუანინი-ციტოზინი — სამი წყალბადური ბმით, ამიტომ გუანინი-ციტოზინის გასახლეჩად უფრო მეტი ენერგიაა საჭირო. გუანინი-ციტოზინის წყვილების პროცენტულობა და დნმ-ის მოლეკულის სიგრძე განაპირობებს ენერგიის რაოდენობას, რომელიც საჭიროა ჯაჭვების დისოციაციისთვის: დნმ-ის გრძელი მოლეკულები გუანინი-ციტოზინის დიდი შემცველობით უფრო მჭიდროა.[21]
დნმ-ის მოლეკულების ნაწილები, რომლებიც მათი ფუნქციის გამო ადვილად დაშორებადი უნდა იყოს, მაგალითად, თ-ა-თ-ა თანმიმდევრობა ბაქტერიულ პრომოტორებში, როგორც წესი, შეიცავენ დიდი რაოდენობით ადენინსა და თიმინს.
ფუძეების ქიმიური მოდიფიკაციები
 |  |  |
ციტოზინი | 5-მეთილციტოზინი | თიმინი |
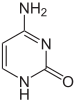
დნმ-ის შემადგენლობაში არსებული აზოტოვანი ფუძეები შეიძლება იყოს კოვალენტურად მოდიფიცირებული, რაც გამოიყენება გენების ექსპრესიის რეგულაციისთვის. მაგალითად, ხერხემლიანთა უჯრედებში ციტოზინის მეთილირებას 5-მეთილციტოზინის წარმოქმნით იყენებენ სომატური უჯრედები, რათა შვილობილ უჯრედებს გადასცენ გენური ექსპრესიის პროფილი. ციტოზინის მეთილირება არ მოქმედებს დნმ-ის ორმაგ სპირალში ფუძეების დაწყვილებაზე. ხერხემლიანების სომატურ უჯრედებში დნმ-ის მეთილირება შემოიფარგლება ციტოზინი-გუანინის თანმიმდევრობაში ციტოზინის მეთილირებით.[22] მეთილირების საშუალო დონე განსხვავებულია სხვადასხვა ორგანიზმებისთვის, ამგვარად, ნემატოდ Caenorhabditis elegans-ს ციტოზინის მეთილირება არ აღენიშნება, ხოლო ხერხემლიანებში აღმოჩენილია მეთილირების მაღალი დონე — 1 %-მდე.[23] ფუძეების სხვა მოდიფიკაციები მოიცავს ბაქტერიებში ადენინის მეთილირებასა და კინეტოპლასტებში ურაცილის გლიკოზილირებას „J-ფუძის“ წარმოქმნით.[24]
ციტოზინის მეთილირება 5-მეთილციტოზინის წარმოქმნით გენის პრომოტორულ ნაწილში კორელირებს მის არააქტიურ მდგომარეობასთან.[25] ციტოზინის მეთილირება აგრეთვე მნიშვნელოვანია ძუძუმწოვრებში X-ქრომოსომის ინაქტივაციისთვის.[26] დნმ-ის მეთილირება გამოიყენება გენომურ იმპრინტინგში.[27] დნმ-ის მეთილირების პროფილი მნიშვნელოვნად ირღვევა კანცეროგენეზის დროს.[28]
ბიოლოგიური როლის მიუხედავად, 5-მეთილციტოზინს შეუძლია სპონტანურად დაკარგოს ამინო ჯგუფი (დეამინირდეს), რითიც იგი თიმინად გარდაიქმნება, ამიტომ მეთილირებული ციტოზინები წარმოადგენს მუტაციების გაზრდილი რაოდენობის წყაროს.[29]
დნმ-ის დაზიანება
ინტერკალირებული ქიმიური კავშირი, რომელიც სპირალის შუაგულშია მოთავსებული — ბენზპირენი, თამბაქოს ბოლის მთავარი მუტაგენია[30]
დნმ შეიძლება დაზიანდეს სხვადასხვა მუტაგენით, რომელთა რიგსაც განეკუთვნება მჟანგავი და მაალკილირებელი ნივთიერებები, აგრეთვე მაღალენერგეტიკული ელექტრომაგნიტური რადიაცია — ულტრაიისფერი და რენტგენული გამოსხივება. დნმ-ის დაზიანების ტიპი დამოკიდებულია მუტაგენზე. მაგალითად, ულტრაიისფერი გამოსხივება დნმ-ს აზიანებს მასში თიმინის დივერების წარმოქმნით, რომლებიც ჩნდება მეზობელ ფუძეებს შორის კოვალენტური ბმების წარმოქმნის დროს.[31]
ოქსიდანტები, როგორებიცაა თავისუფალი რადიკალები ან წყალბადის პეროქსიდი, იწვევენ დნმ-ის დაზიანების რამდენიმე ტიპს, მათ შორის ფუძეების მოდიფიკაციებს, განსაკუთრებით გუანოზინის, აგრეთვე დნმ-ში ორჯაჭვიან გახლეჩვებს.[32] ზოგიერთი შეფასებით, ადამიანის თითოეულ უჯრედში მჟანგავი კავშირებით ყოველდღიურად ზიანდება 500-მდე ფუძე.[33][34] სხვადასხვა ტიპის დაზიანებებს შორის ყველაზე სახიფათო — ეს არის ორჯაჭვიანი გახლეჩვები, რადგან ისინი რთულად რეპარირებენ და შეუძლიათ ქრომოსომების უბნების დაკარგვისა (დელეცია) და ტრანსლოკაციის გამოწვევა.
მუტაგენების მრავალი მოლეკულა ისმება (ინტერკალირდება) ფუძეების ორ მეზობელ წყვილს შორის. ამ კავშირების უმეტესობას, მაგალითად ეთიდიუმს, დაუნორუბიცინს, დოქსორუბიცინსა და თალიდომიდს აქვთ არომატული სტრუქტურა. საიმისოდ, რომ ინტერკალირებადმა კავშირმა მოახერხოს ფუძეებს შორის მოთავსება, ისინი უნდა დაშორდნენ ერთმანეთს და ამგვარად დაშალონ და დაარღვიონ ორმაგი სპირალის სტრუქტურა. დნმ-ის სტრუქტურაში ეს ცვლილებები ხელს უშლის ტრანსკრიფციასა და რეპლიკაციას, იწვევს მუტაციებს. ამიტომ ინტერკალირებადი კავშირები ხშირად წარმოადგენენ კანცეროგენებს, რომელთაგან უფრო მეტად ცნობილია — ბენზპირენი, აკრიდინები, აფლატოქსინი და ეთიდიუმის ბრომიდი.[35][36][37] ამ ნეგატიური თვისებების (ტრანსკრიპციისა და დნმ-ის რეპლიკაციისთვის ხელის შეშლის) მიუხედავად, ინტერკალირებადი კავშირები ქიმიოთერაპიაში გამოიყენება კიბოს სწრაფად ზრდადი უჯრედების დასათრგუნად.[38]
ზესპირალიზაცია
თუკი თოკის ბოლოებს ხელებს ჩავჭიდებთ და მათ ერთმანეთის საპირისპირო მხარეს დავახვევთ, თოკი დამოკლდება და მასზე ხვეულები წარმოიქმნება. ასევე ხდება დნმ-ის სპირალიზაცია. ჩვეულებრივ მდგომარეობაში დნმ-ის ჯაჭვი ერთ ბრუნს აკეთებს ყოველ 10,4 ფუძეზე, მაგრამ ზესპირალიზებულ მდგომარეობაში სპირალი შეიძლება უფრო მჭიდროდ დაეხვეს ან გაიხსნას.[39] განარჩევენ ზესპირალიზაციის ორ ტიპს: დადებითი — ნორმალური ხვეულების მიმართულებით, რომლის დროსაც ფუძეები ერთმანეთთან უფრო ახლოს მდებარეობს; და უარყოფითი — საპირისპირო მიმართულებით. ბუნებაში დნმ-ის მოლეკულები, როგორც წესი, იმყოფებიან უარყოფითად ზესპირალიზებულ მდგომარეობაში, რომელიც ხორციელდება ფერმენტებით — ტოპოიზომერაზებით.[40] ეს ფერმენტები შლიან დამატებით სპირალიზაციას, რომელიც დნმ-ში წარმოიქმნება ტრანსკრიფციისა და რეპლიკაციის შედეგად.[41]

ტელომერების სტრუქტურა. მწვანე ფერით ნაჩვენებია ლითონის იონი, რომელიც ჰელატირებულია სტრუქტურის ცენტრში[42]
სტრუქტურები ქრომოსომათა ბოლოებზე
ხაზოვანი ქრომოსომების ბოლოებზე მდებარეობს დნმ-ის სპეციალიზირებული სტრუქტურები — ტელომერები. ამ უბნების ძირითადი ფუნქცია ქრომოსომათა ბოლოების მთლიანობის ხელშეწყობაა.[43] ტელომერები აგრეთვე იცავენ დნმ-ის ბოლოებს ეგზონუკლეაზებისგან დეგრადაციისგან და ხელს უშლიან რეპარაციის სისტემის აქტივაციას.[44] ვინაიდან ჩვეულებრივ დნმ-პოლიმერაზებს არ შეუძლიათ ქრომოსომათა 3' ბოლოების რეპლიცირება, ამას აკეთებს სპეციალური ფერმენტი — ტელომერაზა.
ადამიანის უჯრედებში ტელომერები ხშირად წარმოდგენილია ერთჯაჭვიანი დნმ-ის სახით და შედგება თ-თ-ა-გ-გ-გ თანმიმდევრობის მქონე რამდენიმე ათასი გამეორებადი ერთეულისგან.[45] გუანინის დიდი შემცველობის მქონე ეს თანმიმდევრობები ასტაბილიზებენ ქრომოსომათა ბოლოებს, ქმნიან საკმაოდ უცნაურ სტრუქტურებს, რომლებსაც ეწოდებათ G-კვადრუპლექსები და რომლებიც შედგებიან ოთხი, და არა ორი, ურთიერთმოქმედი ფუძისაგან. გუანინის ოთხი ფუძე, რომელთა ყველა ატომი ერთ სიბრტყეზე მდებარეობს, ქმნის ფირფიტას, რომელიც სტაბილიზებულია ფუძეებს შორის წყალბადური ბმებითა და მის ცენტრში ლითონის (ხშირ შემთხვევაში კალიუმის) იონის ჰელატირებით. ეს ფირფიტები დასტისებურად არის ერთმანეთზე მოთავსებული.[46]
ქრომოსომათა ბოლოებზე შეიძლება წარმოიქმნას სხვა სტრუქტურებიც: ფუძეები შეიძლება იყოს განლაგებული ერთ ჯაჭვში ან სხვადასხვა პარალელურ ჯაჭვებში. ამგვარი „დასტისებური“ სტრუქტურების გარდა, ტელომერები ქმნიან დიდ მარყუჟისმაგვარ სტრუქტურებს, რომლებსაც T-მარყუჟს ან ტელომერულ მარყუჟს უწოდებენ. მათში ერთჯაჭვიანი დნმ მდებარეობს ფართო რგოლის სახით, რომელიც ტელომერული ცილებითაა სტაბილიზებული.[47] T-მარყუჟის ბოლოს ერთჯაჭვიანი ტელომერული დნმ უერთდება ორჯაჭვიან დნმ-ს, რითიც ამ მოლეკულაში არღვევს ჯაჭვების დაწყვილებას და ქმნის ბმას ერთ-ერთ ჯაჭვთან. ამ სამჯაჭვიან წარმონაქმნს ეწოდება D-მარყუჟი (ინგლ. displacement loop-დან).[46]
ბიოლოგიური ფუნქციები
დნმ არის მატარებელი გენეტიკური ინფორმაციისა, რომელიც გენეტიკური კოდის მეშვეობით ჩაწერილია ნუკლეოტიდების თანმიმდევრობის სახით. დნმ-ის მოლეკულებთან დაკავშირებულია ცოცხალი ორგანიზმების ორი ფუნდამენტური მახასიათებელი — მემკვიდრეობითობა და ცვალებადობა. დნმ-ის რეპლიკაციის დროს წარმოიქმნება საწყისი ჯაჭვის ორი ასლი, რომლებსაც გაყოფის დროს იმემკვიდრებენ შვილობილი უჯრედები. ამგვარად, წარმოქმნილი უჯრედები გენეტიკურად საწყისი უჯრედის იდენტურებია.
გენეტიკური ინფორმაცია რეალიზდება გენების ექსპრესიისას, ტრანსკრიპციისა (დნმ-ის მატრიცაზე რნმ-ის მოლეკულების სინთეზისა) და ტრანსლაციის (რნმ-ის მატრიცაზე ცილების წარმოქმნის) დროს.
ნუკლეოტიდების წყობა „აკოდირებს“ ინფორმაციას რნმ-ის სხვადასხვა ტიპის შესახებ: ინფორმაციული, ანუ მატრიცული (ი-რნმ), რიბოსომული (რ-რნმ) და სატრანსპორტო (ტ-რნმ). რნმ-ის ყველა ეს ტიპი სინთეზირდება ტრანსკრიფციის დროს, დნმ-ზე დაყრდნობით. ცილების ბიოსინთეზში (ტრანსლაციის პროცესში) მათი როლი სხვადასხვაგვარია. ინფორმაციული რნმ შეიცავს ინფორმაციას ცილაში ამინომჟავების თანმიმდევრობის შესახებ, რიბოსომული რნმ-ები წარმოადგენს რიბოსომების (რთული ნუკლეოპროტეინული კომპლექსების, რომელთა მთავარი ფუნქციაც ი-რნმ-ზე დაყრდნობით ცალკეული ამინომჟავებისგან ცილის აგებაა) საფუძველს, ხოლო სატრანსპორტო რნმ-ს ამინომჟავები გადააქვს ცილების აგების ადგილას — რიბოსომის აქტიურ ცენტრში, რომელიც ი-რნმ-ზე „მისრიალებს“.
გენომის სტრუქტურა

ბაქტერიოფაგის გენომის დნმ: ფოტოსურათი სინათლის ელექტრონული მიკროსკოპის ქვეშ
ბუნებრივი დნმ-ების უმრავლესობას აქვს ორჯაჭვიანი სტრუქტურა, ხაზოვანი (ეუკარიოტები, ზოგიერთი ვირუსი და ბაქტერიების ცალკეული ტიპები) ან რგოლოვანი (პროკარიოტები, ქლოროპლასტები და მიტოქონდრიები). ხაზოვანი ერთჯაჭვიანი დნმ აქვს ზოგიერთ ვირუსსა და ბაქტერიოფაგს. დნმ-ის მოლეკულები იმყოფებიან in vivo (ლათ. „ცოცხალში“) მჭიდროდ შეფუთულ, კონდენსირებულ მდგომარეობაში.[48] ეუკარიოტების უჯრედებში დნმ ძირითადად მოთავსებულია ბირთვში ქრომოსომათა ნაკრების სახით. ბაქტერიული (პროკარიოტები) დნმ, როგორც წესი, წარმოდგენილია დნმ-ის ერთი რგოლოვანი მოლეკულით, რომელიც ციტოპლაზმაში არაწესიერი ფორმის მქონე წარმონაქმნში, ნუკლეოიდშია განლაგებული.[49] გენომის გენეტიკური ინფორმაცია შედგება გენებისგან. გენი — ეს არის მემკვიდრული ინფორმაციის გადაცემის ერთეული და დნმ-ის უბანი, რომელიც მოქმედებს ორგანიზმის გარკვეულ მახასიათებელზე. გენი შეიცავს ღია წაკითხვის ჩარჩოს, რომელიც ტრანსკრიბირებს, აგრეთვე მარეგულირებელ თანმიმდევრობებს, მაგალითად, პრომოტორსა და ენჰანსერს, რომლებიც აკონტროლებენ ღია წაკითხვის ჩარჩოების ექსპრესიას.
ბევრ სახეობაში გენომის სრული წყობის მხოლოდ მცირე ნაწილი აკოდირებს ცილებს. ამგვარად, ადამიანის გენომის მხოლოდ 1,5% შედგება ცილების მაკოდირებელი ეგზონებისგან, ხოლო ადამიანის დნმ-ის 50%-ზე მეტი შედგება დნმ-ის არაკოდირებადი გამეორებადი თანმიმდევრობებისგან.[50] ეუკარიოტულ გენომებში არაკოდირებადი დნმ-ის ასეთი დიდი რაოდენობის არსებობისა და გენომების ზომებში უდიდესი სხვაობის (С-მნიშვნელობა) მიზეზები — ერთ-ერთი ამოუხსნელი მეცნიერული თავსატეხებია;[51] ამ დარგში გამოკვლევები აგრეთვე მიანიშნებს დნმ-ის ამ ნაწილში რელიქტური ვირუსების ფრაგმენტების დიდ რაოდენობაზე.
გენომის წყობები, რომლებიც არ აკოდირებენ ცილებს
ამჟამად გროვდება სულ უფრო და უფრო მეტი მონაცემი, რომელიც ეწინააღმდეგება არაკოდირებადი წყობების იდეას, როგორიცაა „უსარგებლო დნმ“ (ინგლ. junk DNA).
ტელომერები და ცენტრომერები შეიცავს გენების მცირე რაოდენობას, მაგრამ ისინი მნიშვნელოვან როლს ასრულებენ ქრომოსომების ფუნქციონირებასა და სტაბილურობაში.[44][52] ადამიანის არაკოდირებადი თანმიმდევრობების საკმაოდ ხშირი ფორმაა ფსევდოგენები, გენების ასლები, რომლებიც ინაქტივირებულია მუტაციების შედეგად.[53] ეს თანმიმდევრობები არის მოლეკულური წიაღისეულების მსგავსი, თუმცა ზოგჯერ საწყისი მასალის როლს ასრულებენ გენების დუპლიკაციასა და მის შემდგომ დივერგენციაში.[54]
ორგანიზმში ცილების მრავალფეროვნების მეორე წყარო არის ალტერნატიულ სპლაისინგში „დაშლისა და შეერთების ხაზების“ როლში ინტრონების გამოყენება.[55]
იმ თანმიმდევრობებს, რომლებიც არ აკოდირებენ ცილებს, შეუძლიათ დამხმარე უჯრედული რნმ-ების კოდირება, მაგალითად, მცირე ბირთვული რნმ-ის.[56] ადამიანის გენომის ტრანსკრიფციის უახლესმა კვლევებმა აჩვენა, რომ გენომის 10% აძლევს საწყისს პოლიადენილირებულ რნმ-ს,[57] ხოლო თაგვის გენომის გამოკვლევებმა აჩვენა, რომ მისი 62% ტრანსკრიბირებს.[58]
ტრანსკრიფცია და ტრანსლაცია
დნმ-ში დაშიფრული გენეტიკური ინფორმაცია უნდა იქნას წაკითხული და საბოლოო ჯამში უნდა აისახოს სხვადასხვა ბიოპოლიმერის სინთეზში, რომელთაგანაც აგებულია უჯრედები. დნმ-ის ჯაჭვში ფუძეების თანმიმდევრობა პირდაპირ საზღვრავს ფუძეების თანმიმდევრობას რნმ-ში, რომელზეც იგი გადაიწერება ტრანსკრიფციის დროს. ი-რნმ-ის შემთხვევაში ეს თანმიმდევრობა საზღვრავს ცილების ამინომჟავებს. ი-რნმ-ის ნუკლეოტიდურ თანმიმდევრობასა და ამინომჟავების თანმიმდევრობას შორის ურთიერთკავშირი ისაზღვრება ტრანსლაციის წესებით, რომლებსაც ეწოდება გენეტიკური კოდი. გენეტიკური კოდი შედგება სამასოიანი „სიტყვებისგან“, რომლებსაც ეწოდებათ კოდონები და რომლებიც შედგებიან სამი ნუკლეოტიდისგან (ანუ ACT, CAG, TTT და ა.შ.). ტრანსკრიფციის დროს რნმ-პოლიმერაზის მიერ გენის ნუკლეოტიდები კოპირდება სინთეზირებად რნმ-ზე. ი-რნმ-ის შემთხვევაში ამ ასლს შიფრავს რიბოსომა, რომელიც ი-რნმ-ის წყობას „კითხულობს“ და ინფორმაციულ რნმ-ს აწყვილებს სატრანსპორტო რნმ-ებთან, რომლებიც ამინომჟავებთანაა დაკავშირებული. გამომდინარე იქიდან, რომ სამასოიან კომბინაციებში გამოიყენება ოთხი ფუძე, სულ არსებობს 64 კოდონი (4³ კომბინაცია). კოდონები აკოდირებენ 20 სტანდარტულ ამინომჟავას, რომელთაგან თითოეულსაც ხშირ შემთხვევაში შეესაბამება ერთზე მეტი კოდონი. ინფორმაციული რნმ-ის ბოლოში მოთავსებული სამი კოდონიდან ერთ-ერთი არ აღნიშნავს ამინომჟავას და განსაზღვრავს ცილის დასასრულს, ესენია „სტოპ-“ ან „ნონსენს-“ კოდონები — TAA, TGA, TAG.
რეპლიკაცია
უჯრედების გაყოფა აუცილებელია ერთუჯრედიანი ორგანიზმის გამრავლებისა და მრავალუჯრედიანი ორგანიზმის გაზრდისათვის, მაგრამ გაყოფამდე უჯრედმა უნდა გააორმაგოს გენომი, რათა შვილობილ უჯრედებს გადაეცეთ იგივე გენეტიკური ინფორმაცია, რომელიც გააჩნდა საწყის უჯრედს. დნმ-ის გაორმაგების (რეპლიკაციის) თეორიულად შესაძლო რამდენიმე მექანიზმიდან რეალიზდება ნახევრადკონსერვატიული. ორი ჯაჭვი ერთმანეთს შორდება, შემდეგ კი დნმ-ის თითოეული უწყვილო კომპლემენტარული თანმიმდევრობა რეპროდუქტირდება (აღდგება) ფერმენტ დნმ-პოლიმერაზას მიერ. ეს ფერმენტი ფუძეების კომპლემენტარობის პრინციპის მიხედვით პოულობს საჭირო ფუძეს და უერთებს მას მშენებარე ჯაჭვს, ამრიგად იგი აგებს პოლინუკლეოტიდურ ჯაჭვს. დნმ-პოლიმერაზას არ შეუძლია ახალი ჯაჭვის დაწყება, იგი მხოლოდ უკვე არსებულს ზრდის, ამიტომ იგი საჭიროებს ნუკლეოტიდების მოკლე ძეწკვს (პრაიმერს), რომელსაც პრაიმაზა ასინთეზირებს. გამომდინარე იქიდან, რომ დნმ-პოლიმერაზებს ჯაჭვის აგება მხოლოდ 5' → 3' მიმართულებით შეუძლია, ანტიპარალელური ჯაჭვების კოპირებისთვის სხვადასხვა მექანიზმები გამოიყენება.[59] რეპლიკაციის შედეგად დნმ-ის ორი ორმაგი სპირალი მიიღება. თითოეული მათგანის ერთი ჯაჭვი ძველი მოლეკულის ნაწილია, მეორე კი — ახლად წარმოქმნილი. სპირალში ჯაჭვების კომპლემენტარობა უზრუნველყოფს იმას, რომ აზოტოვან ფუძეთა მიმდევრობა ორივე სპირალში იდენტურია. ამდენად ისინი ერთი და იმავე ინფორმაციის მატარებლები არიან. დნმ-ის რეპლიკაციისას შესაძლოა მოხდეს შეცდომები: ნუკლეოტიდის ამოვარდნა, ჩამატება ან სხვა ნუკლეოტიდით შეცვლა. ამ მოვლენას მუტაცია ეწოდება. უმეტესი მუტაციები სწორდება უჯრედის რეპარაციული სისტემის საშუალებით.
ურთიერთქმედება ცილებთან
ტრანსკრიფციის ფაქტორის, STAT3-ის ურთიერთქმედება დნმ-თან (ნაჩვენებია ლურჯი სპირალის სახით)
დნმ-ის ყველა ფუნქცია დამოკიდებულია მის უერთიერთქმედებაზე ცილებთან. ურთიერთქმედებები შეიძლება იყოს არასპეციფიკური, როდესაც ცილა უკავშირდება დნმ-ის ნებისმიერ მოლეკულას, ან შეიძლება დამოკიდებული იყოს სპეციალური წყობის არსებობაზე. ფერმენტებს აგრეთვე შეუძლიათ დნმ-თან ურთიერთქმედება, მათგან განსაკუთრებით მნიშვნელოვანია რნმ-პოლიმერაზები, რომლებიც ტრანსკრიფციის ან დნმ-ის ახალი ჯაჭვის სინთეზის — რეპლიკაციის დროს დნმ-ის ფუძეების წყობას რნმ-ზე აკოპირებენ.
სტრუქტურული და მარეგულირებელი ცილები
ცილებისა და დნმ-ის უერთიერთქმედების კარგად შესწავლილ მაგალითს, რომელიც არ არის დამოკიდებული დნმ-ის ნუკლეოტიდურ წყობაზე, წარმოადგენს ურთიერთქმედება სტრუქტურულ ცილებთან. უჯრედში დნმ დაკავშირებულია ამ ცილებთან და ქმნის კომპაქტურ სტრუქტურას, რომელსაც ეწოდება ქრომატინი. პროკარიოტებში ქრომატინი წარმოქმნილია დნმ-ზე მცირე ზომის ტუტე ცილების — ჰისტონების მიერთებით. პროკარიოტების ნაკლებად თანმიმდევრული ქრომატინი შეიცავს ჰისტონისებრ ცილებს.[60][61] ჰისტონები ქმნიან დისკისმაგვარ ცილის სტრუქტურას — ნუკლეოსომას, რომელთაგან თითოეულის გარშემოც ეტევა დნმ-ის სპირალის ორი ბრუნი. ჰისტონებსა და დნმ-ს შორის არასპეციფიკური ბმები წარმოიქმნება ჰისტონების ტუტე ამინომჟავებისა და დნმ-ის შაქარ-ფოსფატის „ხერხემლის“ მჟავური ნაშთების იონური ბმების ხარჯზე.[62] ამ ამინომჟავების ქიმიური მოდიფიკაციები მოიცავს მეთილირებას, ფოსფოლირებასა და აცეტილირებას.[63] ეს ქიმიური მოდიფიკაციები ცვლიან ურთიერთქმედების ძალას დნმ-სა და ჰისტონებს შორის, გავლენას ახდენენ ტრანსკრიფციის ფაქტორებისთვის სპეციფიკური წყობების ხელმისაწვდომობაზე და ცვლიან ტრანსკრიფციის სიჩქარეს.[64] ქრომატინის შემცველობაში შემავალი სხვა ცილები, რომლებიც უერთდებიან არასპეციფიკურ თანმიმდევრობებს, არიან ჟელეებში დიდი მობილურობის მქონე ცილები, რომლებიც უმეტესწილად უერთდებაინ მოხრილ დნმ-ს.[65] ეს ცილები მნიშვნელოვანია ქრომატინში უფრო მაღალი წესრიგის სტრუქტურების წარმოსაქმნელად.[66] ცილების განსაკუთრებული ჯგუფი, რომელიც დნმ-ს უერთდება, — ეს არის ცილები, რომლებიც ასოცირებენ ერთჯაჭვიან დნმ-თან. ადამიანში ამ ჯგუფის ცილების ყველაზე ნათელი მაგალითია რეპლიკაციური ცილა А, რომლის გარეშეც შეუძლებელია მიმდინარეობა ბევრი პროცესისა, რომლებშიც იშლება ორმაგი სპირალი, მათ შორის, რეპლიკაციის, რეკომბინაციისა და რეპარაციის. ამ ჯგუფის ცილები ასტაბილიზირებენ ერთჯაჭვიან დნმ-ს და ხელს უშლიან ნუკლეაზების მიერ დეგრადაციასა და ღერო-მარყუჟების წარმოქმნას.[67]
იმავდროულად სხვა ცილები ცნობენ და უერთდებიან არასპეციფიკურ თანმიმდევრობებს. ასეთი ცილების ყველაზე კარგად შესწავლილი ჯგუფია ტრანსკრიფციის ფაქტორების სხვადასხვა კლასები, ანუ ის ცილები, რომლებიც ტრანსკრიფციას არეგულირებენ. ამ ცილებიდან თითოეული ცნობს თავის თანმიმდევრობას, ხშირად პრომოტორში, და ააქტიურებს ან თრგუნავს გენის ტრანსკრიფციას. ეს ხდება ტრანსკრიფციის ფაქტორების რნმ-პოლიმერაზასთან ასოციაციის დროს, პირდაპირ, ან შუამავალი-ცილების დახმარებით. პოლიმერაზა ჯერ ასოცირდება ცილებთან, შემდეგ კი იწყებს ტრანსკრიფციას.[68] სხვა შემთხვევებში ტრანსკრიფციის ფაქტორებს შეუძლიათ ფერმენტებთან დაკავშირება, რომლებიც პრომოტორებზე მდებარე ჰისტონებს ამოდიფიცირებენ, რაც პოლიმერაზებისთვის ცვლის დნმ-ის ხელმისაწვდომობას.[69]
ვინაიდან სპეციფიკური თანმიმდევრობები გენომის მრავალ უბანში გვხვდება, ერთი ტიპის ტრანსკრიფციის ფაქტორის აქტიურობის შეცვლამ შეიძლება გამოიწვიოს ათასობით გენის აქტიურობის შეცვლა.[70] შესაბამისად, ორგანიზმის განვითარების, უჯრედების დიფერენცირებისა და გარემოში ცვლილებების საპასუხო პროცესების დროს ეს ცილები ხშირად რეგულირდება. ტრანსკრიფციის ფაქტორების დნმ-თან ურთიერთქმედების სპეციფიკურობა უზრუნველყოფილია დნმ-ის ფუძეებსა და ამინომჟავებს შორის მრავალრიცხოვანი კონტაქტებით, რაც მათ დნმ-ის წყობის „წაკითხვის“ საშუალებას აძლევს. ფუძეებთან კონტაქტების უმეტესობა მიმდინარეობს მთავარ ღარში, სადაც ფუძეები უფრო ხელმისაწვდომია.[18]
დნმ-ის მამოდიფიცირებელი ფერმენტები
ტოპოიზომერაზები და ჰელიკაზები
უჯრედში დნმ იმყოფება კომპაქტურ, ეგრეთ წოდებულ ზესპირალიზებულ მდგომარეობაში, წინააღმდეგ შემთხვევაში იგი ვერ მოახერხებდა უჯრედში დატევას. სიცოცხლისთვის მნიშვნელოვანი პროცესების მსვლელობისთვის დნმ უნდა დესპირალიზირდეს, რაც ხორციელდება ცილების ორი ჯგუფის — ტოპოიზომერაზებისა და ჰელიკაზების მეშვეობით.
ტოპოიზომერაზები არის ფერმენტები, რომლებსაც აქვთ როგორც ნუკლეაზური, ასევე ლიგაზური აქტივობა. ისინი ცვლიან დნმ-ის ზესპირალიზაციის დონეს. ამ ფერმენტებიდან ზოგიერთი ჭრის დნმ-ის სპირალს და ჯაჭვებიდან ერთ-ერთს აძლევს ტრიალის საშუალებას. ამგვარად მცირდება ზესპირალიზაციის დონე, რის შემდეგაც ფერმენტი ავსებს ნაპრალს.[40] სხვა ფერმენტებს შეუძლიათ ერთ-ერთი ჯაჭვის გაჭრა და მეორე ჯაჭვის ნაპრალზე გადაყვანა, შემდეგ კი პირველ ჯაჭვში ნაპრალის ლიგირება.[71] ტოპოიზომერაზები აუცილებელია დნმ-თან დაკავშირებული მრავალი პროცესისთვის, როგორებიცაა რეპლიკაცია და ტრანსკრიფცია.[41]
ჰელიკაზები არის ცილები, რომლებიც წარმოადგენენ ერთ-ერთ მოლეკულურ ძრავას. ისინი იყენებენ ნუკლეოტიდტრიფოსფატების, ხშირ შემთხვევაში ატფ-ის, ქიმიურ ენერგიას, რათა ფუძეებს შორის გახლიჩონ წყალბადური ბმები და ორმაგი სპირალი ცალკეულ ჯაჭვებად დაყონ.[72] ეს ფერმენტები მნიშვნელოვანია უამრავი პროცესისთვის, რომლებშიც ცილებს ესაჭიროებათ დნმ-ის ფუძეებთან კავშირი.
ნუკლეაზები და ლიგაზები
უჯრედში მიმდინარე სხვადასხვა პროცესებში, მაგალითად, რეკომბინაციასა და რეპარაციაში, მონაწილეობენ ფერმენტები, რომლებსაც შეუძლიათ დნმ-ის ძაფების მთლიანობის გაჭრა და აღდგენა. დნმ-ის გამჭრელ ფერმენტებს ეწოდებათ ნუკლეაზები. ნუკლეაზებს, რომლებიც დნმ-ის მოლეკულის ბოლოებზე ნუკლეოტიდებს აჰიდროლიზებენ, ეწოდებათ ეგზონუკლეაზები, ხოლო ენდონუკლეაზები დნმ-ს ჯაჭვის შიგნით ჭრიან. მულეკულურ ბიოლოგიასა და გენურ ინჟინერიაში ყველაზე ხშირად გამოყენებადი ნუკლეაზებია რესტრიქციის ენდონუკლეაზები (რესტრიქტაზები), რომლებიც ჭრიან დნმ-ს სპეციფიკური თანმიმდევრობების მახლობლად. მაგალითად, ფერმენტი EcoRV (რესტრიქციული ფერმენტი № 5 E. coli-დან) ცნობს ექვსნუკლეოტიდიან წყობა 5'-GAT|ATC-3'-ს და ჭრის დნმ-ს იმ ადგილას, რომელიც მითითებულია ვერტიკალური ხაზით. ბუნებაში ეს ფერმენტები იცავენ ბაქტერიებს ბაქტერიოფაგებისგან დაავადებისგან. ისინი ფაგის დნმ-ს ჭრიან მაშინ, როცა ეს უკანასკნელი ბაქტერიულ უჯრედში შედის. ამ შემთხვევაში ნუკლეაზები არის მოდიფიკაცია-რესტრიქციის სისტემის ნაწილი.[73]დნმ-ლიგაზები დნმ-ის მოლეკულაში ატფ-ის ენერგიის გამოყენებით შაქარ-ფოსფატის ფუძეებს ერთმანეთზე აკერებენ.
რესტრიქციული ნუკლეაზები და ლიგაზები გამოიყენება კლონირებასა და ფინგერპრინტინგში.
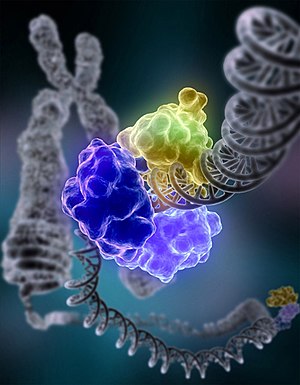
დნმ-ლიგაზა I (რგოლოვანი სტრუქტურა, რომელიც შედგება ცილის რამდენიმე ერთნაირი მოლეკულისგან, რომლებიც სხვადასხვა ფერითაა ნაჩვენები), რომელიც დნმ-ის დაზიანებულ ჯაჭვს ალიგირებს
პოლიმერაზები
არსებობს აგრეთვე მეტაბოლიზმისთვის მნიშვნელოვანი ჯგუფი დნმ ფერმენტებისა, რომლებიც ნუკლეოზიდტრიფოსფატებიდან ასინთეზირებენ პოლინუკლეოტიდების ჯაჭვებს — დნმ-პოლიმერაზები. ისინი დნმ-ის ჯაჭვში წინა ნუკლეოტიდის 3'-ჰიდროქსილის ჯგუფს უმატებენ ნუკლეოტიდებს, ამიტომ ყველა პოლიმერაზა მუშაობს 5' → 3' მიმართულებით.[74] ამ ფერმენტების აქტიურ ცენტრში სუბსტრატი — ნუკლეოზიდტრიფოსფატი — ერთჯაჭვიანი პოლინუკლეოტიდური ჯაჭვის — მატრიცის შემადგენლობაში წყვილდება კომპლემენტარულ ფუძესთან.
დნმ-ის რეპლიკაციის დროს დნმ-ზე დამოკიდებული დნმ-პოლიმერაზა ასინთეზირებს დნმ-ის საწყისი თანმიმდევრობის ასლს. ამ პროცესში სიზუსტე ძალიან მნიშვნელოვანია, რადგან პოლიმერიზაციისას შეცდომები იწვევს მუტაციებს, ამიტომ მრავალი პოლიმერაზა ფლობს შეცდომების გასწორების — „რედაქტირების“ ფუნქციას. სინთეზის დროს არასწორად დაწყვილებულ ნუკლეოტიდებში პოლიმერაზა პოულობს შეცდომას, რის შემდეგაც აქტიურდება პოლიმერაზის 3' → 5' ეგზონუკლეაზური აქტივობა და არასწორი ფუძე იშლება.[75] ორგანიზმების უმეტესობაში დნმ-პოლიმერაზები მუშაობენ დიდი კომპლექსის სახით, რომელსაც ეწოდება რეპლისომა და რომელიც შეიცავს მრავალრიცხოვან დამატებით სუბერთეულებს, მაგალითად, ჰელიკაზებს.[76]
რნმ-ზე დამოკიდებული დნმ-პოლიმერაზები არის პოლიმერაზების სპეციალური ტიპი, რომელიც აკოპირებს რნმ-ის თანმიმდევრობას დნმ-ზე. ამ ტიპს განეკუთვნება ვირუსული ფერმენტი უკუტრანსკრიპტაზა, რომელსაც იყენებენ რეტროვირუსები უჯრედის ინფიცირებისას, აგრეთვე ტელომერაზა, რომელიც აუცილებელია ტელომერების რეპლიკაციისთვის.[77] ტელომერაზა უჩვეულო ფერმენტია, რადგან იგი შეიცავს საკუთარ მატრიცულ რნმ-ს.[44]
ტრანსკრიფცია ხორციელდება დნმ-ზე დამოკიდებული რნმ-პოლიმერაზით, რომელიც დნმ-ის ერთი ჯაჭვის თანმიმდევრობას აკოპირებს ი-რნმ-ზე. გენის ტრანსკრიფციის დაწყებისას რნმ-პოლიმერაზა გენის დასაწყისში, რომელსაც ეწოდება პრომოტორი, უკავშირდება თანმიმდევრობას და შლის დნმ-ის სპირალს. შემდეგ იგი აკოპირებს გენის თანმიმდევრობას ინფორმაციულ რნმ-ზე მანამ, სანამ გენის ბოლოში არ მიაღწევს დნმ-ის უბნამდე — ტერმინატორამდე, სადაც იგი ჩერდება და შორდება დნმ-ს. ისევე, როგორც ადამიანის დნმ-ზე დამოკიდებული დნმ-პოლიმერაზა, რნმ-პოლიმერაზა II, რომელიც ადამიანის გენომის გენების დიდ ნაწილს ატრანსკრიბირებს, მუშაობს ცილების დიდი კომპლექსის შემადგენლობაში, რომელიც შეიცავს მარეგულირებელ და დამატებით ერთეულებს.[78]
გენეტიკური რეკომბინაცია

რეკომბინაცია. საწყის ჯაჭვებს (M და F) შორის ფრაგმენტების გაცვლის შედეგად წარმოიქმნა ახალი ჯაჭვები (C1 და C2).
დნმ-ის ორმაგი სპირალი არ ურთიერთქმედებს დნმ-ის სხვა სეგმენტებთან. ადამიანის უჯრედებში სხვადასხვა ქრომოსომა ბირთვში სივცრობრივად არის ერთმანეთისგან დაშორებული.[79] სხვადასხვა ქრომოსომას შორის ეს მანძილი მნიშვნელოვანია იმისთვის, რომ დნმ-მა მოახერხოს სტაბილური ინფორმაციის მატარებლის ფუნქციის შესრულება. რეკომბინაციის დროს ფერმენტების მეშვეობით დნმ-ის ორი სპირალი შორდება ერთმანეთს, ცვლის უბნებს, რის შემდეგაც სპირალების უწყვეტობა აღდგება, ამიტომ არაჰომოლოგიური ქრომოსომების უბნების გაცვლამ შეიძლება გამოიწვიოს გენეტიკური მასალის მთლიანობის დაზიანება.
 |
 |
რეკომბინაცია ქრომოსომებს გენეტიკური ინფორმაციის გაცვლის საშუალებას აძლევს, რის შედეგადაც იქმნება გენების ახალი კომბინაციები, რაც ზრდის ბუნებრივი გადარჩევის ეფექტურობას და მნიშვნელოვანია ახალი ცილების სწრაფი ევოლუციისთვის.[80] გენეტიკური რეკომბინაცია აგრეთვე მნიშვნელოვან როლს ასრულებს რეპარაციაში, განსაკუთრებით დნმ-ის ორივე ჯაჭვის გაწყვეტისას უჯრედის მიერ საპასუხო რეაქციის განხორციელებაში.[81]
ჩვეულებრივ, რეკომბინაცია დიპლოიდურ ორგანიზმებში ხდება. ეს ორგანიზმები ქრომოსომების ორმაგ ნაკრებს შეიცავენ, ისე, რომ ყოველი ქრომოსომისათვის არსებობს მისი მსგავსი ინფორმაციის შემცველი (ჰომოლოგიური) ქრომოსომა, რომელიც ორგანიზმს მეორე მშობლისგან ერგო. კროსინგოვერის ყველაზე გავრცელებული ფორმაა ჰომოლოგიური რეკომბინაცია, როდესაც რეკომბინაციაში მონაწილე ქრომოსომებს აქვთ ძალიან მსგავსი თანმიმდევრობები. ჰომოლოგიის უბნების როლში ხშირად გვევლინებიან ტრანსპოზონები. არაჰომოლოგიურმა რეკომბინაციამ შეიძლება გამოიწვიოს უჯრედის დაზიანება, რადგან ამგვარი რეკომბინაციის შედეგად წარმოიქმნება ტრანსლოკაციები. რეკომბინაციის რეაქციას აკატალიზირებენ ფერმენტები, რომლებსაც ეწოდებათ რეკომბინაზები, მაგალითად, Cre. რეაქციის პირველ ეტაპზე რეკომბინაზა დნმ-ის ერთ-ერთ ჯაჭვში აკეთებს ნაპრალს, რითიც ამ ჯაჭვს აძლევს კომპლემენტარული ჯაჭვისგან დაშორებისა და მეორე ქრომატიდის ერთ-ერთ ჯაჭვთან დაკავშირების საშუალებას. მეორე ქრომატიდის ჯაჭვში მეორე ნაპრალი მას აგრეთვე აძლევს დაშორებისა და პირველი ქრომატიდის უწყვილო ჯაჭვთან დაკავშირების საშუალებას, რითიც იქმნება ჰოლიდეის სტრუქტურა. ჰოლიდეის სტრუქტურას შეუძლია ქრომოსომების შეერთებული წყვილის გასწვრივ გადაადგილება და ჯაჭვებისთვის ადგილის გაცვლა. რეკომბინაციის რეაქცია სრულდება, როდესაც ფერმენტი ჭრის კავშირს, ხოლო ორი ჯაჭვი ლიგირდება.[82] სქემაზე (მარჯვნივ) გამოხატულია ამ პროცესის შუალედური ფორმა, რომელიც სადღესასწაულო მოსართავს წააგავს.
დნმ-ზე დამყარებული მეტაბოლიზმის ევოლუცია
დნმ შეიცავს გენეტიკურ ინფორმაციას, რომელიც შესაძლებელს ხდის ყველა თანამედროვე ორგანიზმის ცხოველმოქმედებას, ზრდას, განვითარებასა და გამრავლებას. თუმცა უცნობია, დედამიწაზე სიცოცხლის ისტორიის ოთხი მილიარდი წლის მანძილზე რამდენი ხნის განმავლობაში იყო დნმ გენეტიკური ინფორმაციის მთავარი მატარებელი. არსებობს ჰიპოთეზები, რომ ნივთიერებათა ცვლაში ცენტრალურ როლს რნმ ასრულებდა, ვინაიდან მას შეუძლია, როგორც გენეტიკური ინფორმაციის გადატანა, ასევე რიბოზიმების დახმარებით კატალიზის განხორციელება.[83][84][85] გარდა ამისა, რნმ არის ცილების ქარხნის — რიბოსომების ერთ-ერთი მთავარი კომპონენტი. ძველი რნმ-სამყარო, სადაც ნუკლეინის მჟავა გამოიყენებოდა როგორც კატალიზისთვის, ასევე ინფორმაციის გადატანისთვის, შეიძლება იყოს წყარო თანამედროვე გენეტიკური კოდისა, რომელიც შედგება ოთხი ფუძისგან. ეს შეიძლება მომხდარიყო იმის შედეგად, რომ ორგანიზმში ფუძეების რაოდენობა წარმოადგენდა კომპრომისს ფუძეების მცირე (რომელიც ზრდიდა რეპლიკაციის სიზუსტეს) და დიდ რაოდენობებს შორის (რომელიც ზრდიდა რიბოზიმების კატალიზურ აქტიურობას).[86]
სამწუხაროდ, ძველმა გენეტიკურმა სისტემებმა დღემდე ვერ მოაღწიეს. დნმ გარემოში საშუალოდ ინახება 1 მილიონი წლის განმავლობაში, შემდეგ კი დეგრადირდება მოკლე ფრაგმენტებად. მარილის კრისტალებში 250 მილიონი წლის წინ „დატყვევებული“ ბაქტერიული სპორებიდან[87] დნმ-ის გამოყოფა და მისი 16S რ-რნმ გენების თანმიმდევრობის განსაზღვრა ამჟამად ერთ-ერთი ყველაზე აქტუალური თემაა.[88][89]
იხილეთ აგრეთვე
- დნმ-ის მეთილირება
- მუტაცია
- ნუკლეოტიდები
- რნმ
- მიტოზი
- მეიოზი
- კრისტალოგრაფია
ლიტერატურა
Berry, Andrew; Watson, James D. (2003). DNA: the secret of life. New York: Alfred A. Knopf. ISBN 0-375-41546-7.
Calladine, Chris R.; Drew, Horace R.; Luisi, Ben F. and Travers, Andrew A. (2003). Understanding DNA: the molecule & how it works. Amsterdam: Elsevier Academic Press. ISBN 0-12-155089-3.
Dennis, Carina; Julie Clayton (2003). 50 years of DNA. Basingstoke: Palgrave Macmillan. ISBN 1-4039-1479-6.- Judson, Horace F. 1979. The Eighth Day of Creation: Makers of the Revolution in Biology. Touchstone Books, ISBN 0-671-22540-5. 2nd edition: Cold Spring Harbor Laboratory Press, 1996 paperback: ISBN 0-87969-478-5.
Olby, Robert C. (1994). The path to the double helix: the discovery of DNA. New York: Dover Publications. ISBN 0-486-68117-3. , first published in October 1974 by MacMillan, with foreword by Francis Crick;the definitive DNA textbook,revised in 1994 with a 9 page postscript- Micklas, David. 2003. DNA Science: A First Course. Cold Spring Harbor Press: ISBN 978-0-87969-636-8
Альбертс Б., Брей Д., Льюис Дж. и др. Молекулярная биология клетки в 3-х томах. — М.: Мир, 1994. — 1558 с. — ISBN 5-03-001986-3.
Докинз Р. Эгоистичный ген. — М.: Мир.- История биологии с начала XX века до наших дней. — М.: Наука, 1975. — 660 с.
Льюин Б. Гены. — М.: Мир, 1987. — 1064 с.
Пташне М. Переключение генов. Регуляция генной активности и фаг лямбда. — М.: Мир, 1989. — 160 с. ყველა ფორუმი > მ. პტაშნეს წიგნი „გენთა გადართვა“
Уотсон Дж. Д. ორმაგი სპირალი: მოგონებები დნმ-ის სტრუქტურის აღმოჩენის შესახებ. — М.: Мир, 1969. — 152 с.
რესურსები ინტერნეტში
- DNA binding site prediction on protein
- დნმ — ორმაგი სპირალის თამაში
- დნმ ელექტრონული მიკროსკოპის ქვეშ
- დნმ-ის შესწავლის ცენტრი
- ორმაგი სპირალი: დნმ-ის 50 წელიწადი
- დნმ-ის გამოყოფისა და გამოკვლევების მეთოდები
- მოლეკულურ-ბიოლოგიური ჟურნალების ვებმისამართები
მონაცემთა საერთაშორისო ბაზა — დნმ-ის თანმიმდევრობები სხვადასხვა ორგანიზმებში (ინგლისური).
სენგეროვის ინსტიტუტის ვებსაიტი — დნმ-ის თანმიმდევრობების განსაზღვრისა და მათი ანალიზის ერთ-ერთი ლიდერი მსოფლიოში (ინგლისური)- Software for forensic DNA Typing — eQMS::DNA
სქოლიო
↑ Erica Westly. (2008-10-06) No Nobel for You: Top 10 Nobel Snubs. Rosalind Franklin--her work on the structure of DNA never received a Nobel. Scientific American. დაარქივებულია ორიგინალიდან - 2014-01-09. წაკითხვის თარიღი: 2013-11-18.
↑ Dahm R (2005). "Friedrich Miescher and the discovery of DNA". Dev Biol 278 (2): 274–88. PMID 15680349.
↑ Hershey A, Chase M (1952). "Independent functions of viral protein and nucleic acid in growth of bacteriophage". J Gen Physiol 36 (1): 39–56. PMID 12981234. http://www.jgp.org/cgi/reprint/36/1/39.pdf.- ↑ 4.04.1Watson J, Crick F (1953). "Molecular structure of nucleic acids; a structure for deoxyribose nucleic acid". Nature 171 (4356): 737 – 8. PMID 13054692. http://profiles.nlm.nih.gov/SC/B/B/Y/W/_/scbbyw.pdf.
↑ The Nobel Prize in Physiology or Medicine 1962 Nobelprize .org Accessed 22 Dec 06
↑ Н. Домрина В России есть кому делать науку — если будет на что // Журнал «Наука и жизнь», № 2, 2002
↑ Maxim Frank-Kamenetskii DNA structure: A simple solution to the stability of the double helix? // ჟურნალი Nature № 324, 305 (27 November 1986)
↑ Maxim Frank-Kamenetskii H-form DNA and the hairpin-triplex model // Журнал Nature № 333, 214 (19 May 1988)
↑ Alberts, Bruce; Alexander Johnson, Julian Lewis, Martin Raff, Keith Roberts, and Peter Walters (2002). Molecular Biology of the Cell; Fourth Edition. New York and London: Garland Science. ISBN 0-8153-3218-1.
↑ Butler, John M. (2001) Forensic DNA Typing «Elsevier». pp. 14 — 15. ISBN 978-0-12-147951-0- ↑ 11.011.1Berg J., Tymoczko J. and Stryer L. (2002) Biochemistry. W. H. Freeman and Company ISBN 0-7167-4955-6
↑ Abbreviations and Symbols for Nucleic Acids, Polynucleotides and their Constituents IUPAC-IUB Commission on Biochemical Nomenclature (CBN) Accessed 03 Jan 2006
↑ Takahashi I, Marmur J. (1963). "Replacement of thymidylic acid by deoxyuridylic acid in the deoxyribonucleic acid of a transducing phage for Bacillus subtilis". Nature 197: 794 – 5. PMID 13980287.
↑ Agris P (2004). "Decoding the genome: a modified view". Nucleic Acids Res 32 (1): 223 – 38. PMID 14715921. http://www.pubmedcentral.nih.gov/articlerender.fcgi?tool=pubmed&pubmedid=14715921.
↑ Ghosh A, Bansal M (2003). "A glossary of DNA structures from A to Z". Acta Crystallogr D Biol Crystallogr 59 (Pt 4): 620 – 6. PMID 12657780.
↑ Mandelkern M, Elias J, Eden D, Crothers D (1981). "The dimensions of DNA in solution". J Mol Biol 152 (1): 153 – 61. PMID 7338906.
↑ Wing R, Drew H, Takano T, Broka C, Tanaka S, Itakura K, Dickerson R (1980). "Crystal structure analysis of a complete turn of B-DNA". Nature 287 (5784): 755 – 8. PMID 7432492.- ↑ 18.018.1Pabo C, Sauer R. "Protein-DNA recognition". Annu Rev Biochem 53: 293 – 321. PMID 6236744.
↑ Ponnuswamy P, Gromiha M (1994). "On the conformational stability of oligonucleotide duplexes and tRNA molecules". J Theor Biol 169 (4): 419–32. PMID 7526075.
↑ Clausen-Schaumann H, Rief M, Tolksdorf C, Gaub H (2000). "Mechanical stability of single DNA molecules". Biophys J 78 (4): 1997–2007. PMID 10733978. http://www.pubmedcentral.nih.gov/picrender.fcgi?artid=1300792&blobtype=pdf.
↑ Chalikian T, Völker J, Plum G, Breslauer K (1999). "A more unified picture for the thermodynamics of nucleic acid duplex melting: a characterization by calorimetric and volumetric techniques". Proc Natl Acad Sci U S A 96 (14): 7853–8. PMID 10393911. http://www.pubmedcentral.nih.gov/picrender.fcgi?artid=22151&blobtype=pdf.
↑ Молекулярная биология клетки: в 3-х томах / Б. Альбертс, А. Джонсон, Д. Льюис и др. — М.-Ижевск: НИЦ «Регулярная и хаотическая динамика», Институт компьютерных исследований, 2013. — ტომი: I. — გვ. 719-733. — 808 გვ . — ISBN 978-5-4344-0112-8
↑ Bird A (2002). "DNA methylation patterns and epigenetic memory". Genes Dev 16 (1): 6 – 21. PMID 11782440.
↑ Gommers-Ampt J, Van Leeuwen F, de Beer A, Vliegenthart J, Dizdaroglu M, Kowalak J, Crain P, Borst P (1993). "beta-D-glucosyl-hydroxymethyluracil: a novel modified base present in the DNA of the parasitic protozoan T. brucei". Cell 75 (6): 1129 – 36. PMID 8261512.
↑ Jones P. A. Functions of DNA methylation: islands, start sites, gene bodies and beyond // Nature Reviews Genetics. — 2012. — В. Nature Reviews Genetics. — Т. 13. — № 7. — გვ. 484-492.
↑ Klose R, Bird A (2006). "Genomic DNA methylation: the mark and its mediators". Trends Biochem Sci 31 (2): 89 – 97. PMID 16403636.
↑ Li E., Beard C., Jaenisch R. Role for DNA methylation in genomic imprinting //Nature. – 1993. – Т. 366. – №. 6453. – С. 362-365
↑ Ehrlich M. DNA methylation in cancer: too much, but also too little //Oncogene. – 2002. – Т. 21. – №. 35. – С. 5400-5413
↑ Walsh C, Xu G. "Cytosine methylation and DNA repair". Curr Top Microbiol Immunol 301: 283 – 315. PMID 16570853.
↑ Created from PDB 1JDG
↑ Douki T, Reynaud-Angelin A, Cadet J, Sage E (2003). "Bipyrimidine photoproducts rather than oxidative lesions are the main type of DNA damage involved in the genotoxic effect of solar UVA radiation". Biochemistry 42 (30): 9221 – 6. PMID 12885257.
↑ Cadet J, Delatour T, Douki T, Gasparutto D, Pouget J, Ravanat J, Sauvaigo S (1999). "Hydroxyl radicals and DNA base damage". Mutat Res 424 (1 – 2): 9 – 21. PMID 10064846.
↑ Shigenaga M, Gimeno C, Ames B (1989). "Urinary 8-hydroxy-2′-deoxyguanosine as a biological marker of in vivo oxidative DNA damage". Proc Natl Acad Sci U S A 86 (24): 9697 – 701. PMID 2602371. http://www.pnas.org/cgi/reprint/86/24/9697.
↑ Cathcart R, Schwiers E, Saul R, Ames B (1984). "Thymine glycol and thymidine glycol in human and rat urine: a possible assay for oxidative DNA damage". Proc Natl Acad Sci U S A 81 (18): 5633 – 7. PMID 6592579. http://www.pnas.org/cgi/reprint/81/18/5633.pdf.
↑ Ferguson L, Denny W (1991). "The genetic toxicology of acridines". Mutat Res 258 (2): 123 – 60. PMID 1881402.
↑ Jeffrey A (1985). "DNA modification by chemical carcinogens". Pharmacol Ther 28 (2): 237 – 72. PMID 3936066.
↑ Stephens T, Bunde C, Fillmore B (2000). "Mechanism of action in thalidomide teratogenesis". Biochem Pharmacol 59 (12): 1489 – 99. PMID 10799645.
↑ Braña M, Cacho M, Gradillas A, de Pascual-Teresa B, Ramos A (2001). "Intercalators as anticancer drugs". Curr Pharm Des 7 (17): 1745 – 80. PMID 11562309.
↑ Benham C, Mielke S (2005). "DNA mechanics". Annu Rev Biomed Eng 7: 21–53. PMID 16004565.- ↑ 40.040.1Champoux J (2001). "DNA topoisomerases: structure, function, and mechanism". Annu Rev Biochem 70: 369–413. PMID 11395412.
- ↑ 41.041.1Wang J (2002). "Cellular roles of DNA topoisomerases: a molecular perspective". Nat Rev Mol Cell Biol 3 (6): 430–40. PMID 12042765.
↑ Created from NDB UD0017
↑ Greider C, Blackburn E (1985). "Identification of a specific telomere terminal transferase activity in Tetrahymena extracts". Cell 43 (2 Pt 1): 405–13. PMID 3907856.- ↑ 44.044.144.2Nugent C, Lundblad V (1998). "The telomerase reverse transcriptase: components and regulation". Genes Dev 12 (8): 1073–85. PMID 9553037. http://www.genesdev.org/cgi/content/full/12/8/1073.
↑ Wright W, Tesmer V, Huffman K, Levene S, Shay J (1997). "Normal human chromosomes have long G-rich telomeric overhangs at one end". Genes Dev 11 (21): 2801–9. PMID 9353250. http://www.genesdev.org/cgi/content/full/11/21/2801.- ↑ 46.046.1Burge S, Parkinson G, Hazel P, Todd A, Neidle S (2006). "Quadruplex DNA: sequence, topology and structure". Nucleic Acids Res 34 (19): 5402–15. PMID 17012276. http://www.pubmedcentral.nih.gov/articlerender.fcgi?tool=pubmed&pubmedid=17012276.
↑ Griffith J, Comeau L, Rosenfield S, Stansel R, Bianchi A, Moss H, de Lange T (1999). "Mammalian telomeres end in a large duplex loop". Cell 97 (4): 503–14. PMID 10338214.
↑ Teif V.B. and Bohinc K. (2010). "Condensed DNA: condensing the concepts". Progress in Biophysics and Molecular Biology. .
↑ Thanbichler M, Wang S, Shapiro L (2005). "The bacterial nucleoid: a highly organized and dynamic structure". J Cell Biochem 96 (3): 506 – 21. PMID 15988757.
↑ Wolfsberg T, McEntyre J, Schuler G (2001). "Guide to the draft human genome". Nature 409 (6822): 824 – 6. PMID 11236998.
↑ Gregory T (2005). "The C-value enigma in plants and animals: a review of parallels and an appeal for partnership". Ann Bot (Lond) 95 (1): 133 – 46. PMID 15596463. http://aob.oxfordjournals.org/cgi/content/full/95/1/133.
↑ Pidoux A, Allshire R (2005). "The role of heterochromatin in centromere function". Philos Trans R Soc Lond B Biol Sci 360 (1455): 569 – 79. PMID 15905142. http://journals.royalsociety.org/content/px7ahm740dq5ueuk/fulltext.pdf.
↑ Harrison P, Hegyi H, Balasubramanian S, Luscombe N, Bertone P, Echols N, Johnson T, Gerstein M (2002). "Molecular fossils in the human genome: identification and analysis of the pseudogenes in chromosomes 21 and 22". Genome Res 12 (2): 272 – 80. PMID 11827946. http://www.genome.org/cgi/content/full/12/2/272.
↑ Harrison P, Gerstein M (2002). "Studying genomes through the aeons: protein families, pseudogenes and proteome evolution". J Mol Biol 318 (5): 1155 – 74. PMID 12083509.
↑ Soller M (2006). "Molecular fossils in the human genome: identification and analysis of the pseudogenes in chromosomes 21 and 22". Cell Mol Life Sci 63 (7-9): 796 – 819. PMID 16465448. http://springerlink.com/content/y12529875j170122.
↑ Michalak P. (2006). RNA world - the dark matter of evolutionary genomics. 19. pp. 1768 – 74. PMID 17040373. http://www.blackwell-synergy.com/doi/abs/10.1111/j.1420-9101.2006.01141.x.
↑ Cheng J, Kapranov P, Drenkow J, Dike S, Brubaker S et al. (2005). RNA world - the dark matter of evolutionary genomics. 308. pp. 1149 – 54. PMID 15790807. http://sciencemag.org/cgi/content/full/308/5725/1149.
↑ Mattick JS (2004). "RNA regulation: a new genetics?". Nat Rev Genet 5: 316–323. PMID 15131654. http://www.nature.com//nrg/journal/v5/n4/abs/nrg1321_fs.html;jsessionid=38CA337C2CE6EC04821E4D35AD67995C.
↑ Albà M (2001). "Replicative DNA polymerases". Genome Biol 2 (1): REVIEWS3002. PMID 11178285. http://www.pubmedcentral.nih.gov/articlerender.fcgi?tool=pubmed&pubmedid=11178285.
↑ Sandman K, Pereira S, Reeve J (1998). "Diversity of prokaryotic chromosomal proteins and the origin of the nucleosome". Cell Mol Life Sci 54 (12): 1350 – 64. PMID 9893710.
↑ Dame RT (2005). "The role of nucleoid-associated proteins in the organization and compaction of bacterial chromatin". Mol. Microbiol. 56 (4): 858–70. PMID 15853876.
↑ Luger K, Mäder A, Richmond R, Sargent D, Richmond T (1997). "Crystal structure of the nucleosome core particle at 2.8 A resolution". Nature 389 (6648): 251 – 60. PMID 9305837.
↑ Jenuwein T, Allis C (2001). "Translating the histone code". Science 293 (5532): 1074 – 80. PMID 11498575.
↑ Ito T. "Nucleosome assembly and remodelling". Curr Top Microbiol Immunol 274: 1 – 22. PMID 12596902.
↑ Thomas J (2001). "HMG1 and 2: architectural DNA-binding proteins". Biochem Soc Trans 29 (Pt 4): 395 – 401. PMID 11497996.
↑ Grosschedl R, Giese K, Pagel J (1994). "HMG domain proteins: architectural elements in the assembly of nucleoprotein structures". Trends Genet 10 (3): 94–100. PMID 8178371.
↑ Iftode C, Daniely Y, Borowiec J (1999). "Replication protein A (RPA): the eukaryotic SSB". Crit Rev Biochem Mol Biol 34 (3): 141 – 80. PMID 10473346.
↑ Myers L, Kornberg R. "Mediator of transcriptional regulation". Annu Rev Biochem 69: 729 – 49. PMID 10966474.
↑ Spiegelman B, Heinrich R (2004). "Biological control through regulated transcriptional coactivators". Cell 119 (2): 157–67. PMID 15479634.
↑ Li Z, Van Calcar S, Qu C, Cavenee W, Zhang M, Ren B (2003). "A global transcriptional regulatory role for c-Myc in Burkitt's lymphoma cells". Proc Natl Acad Sci U S A 100 (14): 8164 – 9. PMID 12808131. http://www.pubmedcentral.nih.gov/articlerender.fcgi?tool=pubmed&pubmedid=12808131.
↑ Schoeffler A, Berger J (2005). "Recent advances in understanding structure-function relationships in the type II topoisomerase mechanism". Biochem Soc Trans 33 (Pt 6): 1465 – 70. PMID 16246147.
↑ Tuteja N, Tuteja R (2004). "Unraveling DNA helicases. Motif, structure, mechanism and function". Eur J Biochem 271 (10): 1849–63. PMID 15128295. http://www.blackwell-synergy.com/links/doi/10.1111/j.1432-1033.2004.04094.x.
↑ Bickle T, Krüger D (1993). "Biology of DNA restriction". Microbiol Rev 57 (2): 434 – 50. PMID 8336674. http://www.pubmedcentral.nih.gov/picrender.fcgi?artid=372918&blobtype=pdf.
↑ Joyce C, Steitz T (1995). "Polymerase structures and function: variations on a theme?". J Bacteriol 177 (22): 6321 – 9. PMID 7592405. http://www.pubmedcentral.nih.gov/picrender.fcgi?artid=177480&blobtype=pdf.
↑ Hubscher U, Maga G, Spadari S. "Eukaryotic DNA polymerases". Annu Rev Biochem 71: 133 – 63. PMID 12045093.
↑ Johnson A, O'Donnell M. "Cellular DNA replicases: components and dynamics at the replication fork". Annu Rev Biochem 74: 283 – 315. PMID 15952889.
↑ Tarrago-Litvak L, Andréola M, Nevinsky G, Sarih-Cottin L, Litvak S (1994). "The reverse transcriptase of HIV-1: from enzymology to therapeutic intervention". FASEB J 8 (8): 497–503. PMID 7514143. http://www.fasebj.org/cgi/reprint/8/8/497.
↑ Martinez E (2002). "Multi-protein complexes in eukaryotic gene transcription". Plant Mol Biol 50 (6): 925 – 47. PMID 12516863.
↑ Cremer T, Cremer C (2001). "Chromosome territories, nuclear architecture and gene regulation in mammalian cells". Nat Rev Genet 2 (4): 292–301. PMID 11283701.
↑ Pál C, Papp B, Lercher M (2006). "An integrated view of protein evolution". Nat Rev Genet 7 (5): 337 – 48. PMID 16619049.
↑ O'Driscoll M, Jeggo P (2006). "The role of double-strand break repair - insights from human genetics". Nat Rev Genet 7 (1): 45 – 54. PMID 16369571.
↑ Dickman M, Ingleston S, Sedelnikova S, Rafferty J, Lloyd R, Grasby J, Hornby D (2002). "The RuvABC resolvasome". Eur J Biochem 269 (22): 5492 – 501. PMID 12423347.
↑ Joyce G (2002). "The antiquity of RNA-based evolution". Nature 418 (6894): 214 – 21. PMID 12110897.
↑ Orgel L. "Prebiotic chemistry and the origin of the RNA world". Crit Rev Biochem Mol Biol 39 (2): 99 – 123. PMID 15217990. http://web.archive.org/web/20070628064747/http://www.crbmb.com/cgi/reprint/39/2/99.pdf.
↑ Davenport R (2001). "Ribozymes. Making copies in the RNA world". Science 292 (5520): 1278. PMID 11360970.
↑ Szathmáry E (1992). "What is the optimum size for the genetic alphabet?". Proc Natl Acad Sci U S A 89 (7): 2614 – 8. PMID 1372984. http://www.pnas.org/cgi/reprint/89/7/2614.pdf.
↑ Vreeland R, Rosenzweig W, Powers D (2000). "Isolation of a 250 million-year-old halotolerant bacterium from a primary salt crystal". Nature 407 (6806): 897 – 900. PMID 11057666.
↑ Hebsgaard M, Phillips M, Willerslev E (2005). "Geologically ancient DNA: fact or artefact?". Trends Microbiol 13 (5): 212 – 20. PMID 15866038.
↑ Nickle D, Learn G, Rain M, Mullins J, Mittler J (2002). "Curiously modern DNA for a "250 million-year-old" bacterium". J Mol Evol 54 (1): 134 – 7. PMID 11734907.
(RLQ=window.RLQ||[]).push(function()mw.log.warn("Gadget "ReferenceTooltips" was not loaded. Please migrate it to use ResourceLoader. See u003Chttps://ka.wikipedia.org/wiki/%E1%83%A1%E1%83%9E%E1%83%94%E1%83%AA%E1%83%98%E1%83%90%E1%83%9A%E1%83%A3%E1%83%A0%E1%83%98:Gadgetsu003E."););
კატეგორია:
- დნმ
- გენეტიკა
- რადიობიოლოგია
- რჩეული სტატიები
(RLQ=window.RLQ||[]).push(function()mw.config.set("wgPageParseReport":"limitreport":"cputime":"0.944","walltime":"1.094","ppvisitednodes":"value":41710,"limit":1000000,"ppgeneratednodes":"value":0,"limit":1500000,"postexpandincludesize":"value":179426,"limit":2097152,"templateargumentsize":"value":73193,"limit":2097152,"expansiondepth":"value":15,"limit":40,"expensivefunctioncount":"value":0,"limit":500,"unstrip-depth":"value":0,"limit":20,"unstrip-size":"value":69990,"limit":5000000,"entityaccesscount":"value":0,"limit":400,"timingprofile":["100.00% 704.273 1 -total"," 82.04% 577.758 1 თარგი:Reflist"," 60.78% 428.042 74 თარგი:Cite_journal"," 56.09% 394.995 74 თარგი:Citation/core"," 4.91% 34.592 74 თარგი:Citation/make_link"," 4.91% 34.554 18 თარგი:Citation/identifier"," 3.67% 25.824 11 თარგი:Main"," 2.02% 14.229 5 თარგი:Cite_book"," 1.93% 13.595 2 თარგი:Ref-en"," 1.62% 11.434 11 თარგი:მულტიპარამეტრი-ბმულით"],"scribunto":"limitreport-timeusage":"value":"0.004","limit":"10.000","limitreport-memusage":"value":551886,"limit":52428800,"cachereport":"origin":"mw1263","timestamp":"20190726113000","ttl":2592000,"transientcontent":false););"@context":"https://schema.org","@type":"Article","name":"u10d3u10d4u10d6u10ddu10e5u10e1u10d8u10e0u10d8u10d1u10ddu10dcu10e3u10d9u10dau10d4u10d8u10dcu10d8u10e1 u10dbu10dfu10d0u10d5u10d0","url":"https://ka.wikipedia.org/wiki/%E1%83%93%E1%83%94%E1%83%96%E1%83%9D%E1%83%A5%E1%83%A1%E1%83%98%E1%83%A0%E1%83%98%E1%83%91%E1%83%9D%E1%83%9C%E1%83%A3%E1%83%99%E1%83%9A%E1%83%94%E1%83%98%E1%83%9C%E1%83%98%E1%83%A1_%E1%83%9B%E1%83%9F%E1%83%90%E1%83%95%E1%83%90","sameAs":"http://www.wikidata.org/entity/Q7430","mainEntity":"http://www.wikidata.org/entity/Q7430","author":"@type":"Organization","name":"Contributors to Wikimedia projects","publisher":"@type":"Organization","name":"Wikimedia Foundation, Inc.","logo":"@type":"ImageObject","url":"https://www.wikimedia.org/static/images/wmf-hor-googpub.png","datePublished":"2007-02-22T16:37:08Z","image":"https://upload.wikimedia.org/wikipedia/commons/8/81/ADN_animation.gif"(RLQ=window.RLQ||[]).push(function()mw.config.set("wgBackendResponseTime":183,"wgHostname":"mw1265"););