Ozmózis Tartalomjegyzék Az ozmózis mechanizmusa Az ozmózis oka Az ozmózisnyomás és a fordított ozmózis van 't Hoff-törvény Az ozmózis gyakorlati szerepe Források Kapcsolódó szócikkek További információk Navigációs menüellenőrizve
Fizikai kémiaBiofizika
molekulákionokszolvatálódnakhidratációnakoldatokbandiffúziókomponensekkémiai potenciáljatranszportjelenségkémiai potenciálkülönbségkomponenseioldathidrosztatikai nyomáshidrosztatikai nyomásA gőznyomáscsökkenés törvényebarometrikus nyomáscsökkenésRaoult-törvénymoltörtekremóltörtmolaritásmolaritástökéletes gázokraáltalános gáztörvényheznyomásanövényiállatisejtekoldatvízbartbar(m/m)nátrium-kloridNaClinfúzióhozvérhemodialíziscelofántcukorgyártásdiffúziós
(function()var node=document.getElementById("mw-dismissablenotice-anonplace");if(node)node.outerHTML="u003Cdiv class="mw-dismissable-notice"u003Eu003Cdiv class="mw-dismissable-notice-close"u003E[u003Ca tabindex="0" role="button"u003Eelrejtu003C/au003E]u003C/divu003Eu003Cdiv class="mw-dismissable-notice-body"u003Eu003Cdiv id="localNotice" lang="hu" dir="ltr"u003Eu003Cdiv style="padding:3px 10px 3px 10px; margin:10px; border:1px solid #b3b7ff; font-size:95%; text-align:center;"u003Enu003Cpu003Eu003Cbu003E2019. május 4-én (szombaton) u003Ca href="/wiki/Wikip%C3%A9dia:Wikital%C3%A1lkoz%C3%B3k/Budapest,_2019._m%C3%A1jus_4." title="Wikipédia:Wikitalálkozók/Budapest, 2019. május 4."u003Ewikipédistatalálkozótu003C/au003Eu003C/bu003E tartunk Budapesten, ahol szeretettel várunk!nu003C/pu003Enu003Chr style="background-color:#b3b7ff; margin:0 2em;" /u003Enu003Cpu003Eu003Cbu003Eu003Ca href="/wiki/Wikip%C3%A9dia:Wikital%C3%A1lkoz%C3%B3k/Wikit%C3%A1bor/2019" title="Wikipédia:Wikitalálkozók/Wikitábor/2019"u003EMegbeszélés az idei Wikitáborral kapcsolatbanu003C/au003E.u003C/bu003E Vegyél részt te is!nu003C/pu003Enu003C/divu003Eu003C/divu003Eu003C/divu003Eu003C/divu003E";());
Ozmózis
Ugrás a navigációhoz
Ugrás a kereséshez

Hidratált ionok képződése
Az ozmózis egy olyan folyamat, melyben az oldószer két, féligáteresztő membránnal elválasztott, különböző koncentrációjú oldat között áramlik. Az oldószer a hígabb oldatból a töményebb felé vándorol. Az ozmózis megáll, ha a két oldat koncentrációja egyenlővé válik, vagy ha kellő nyomás helyeződik a hártya nagyobb koncentrációjú oldalán lévő oldatra.
Tartalomjegyzék
1 Az ozmózis mechanizmusa
2 Az ozmózis oka
3 Az ozmózisnyomás és a fordított ozmózis
4 van 't Hoff-törvény
5 Az ozmózis gyakorlati szerepe
6 Források
7 Kapcsolódó szócikkek
8 További információk
Az ozmózis mechanizmusa
Az oldatokban az oldódó részecskék – molekulák, ionok – oldószer-molekulákat kötnek meg maguk körül, azaz szolvatálódnak (a vizes rendszerekben ezt a folyamatot hidratációnak nevezik).
Ha híg az oldat, akkor az oldott részecskék körül szabadon kialakul a szolvátréteg és marad szabad oldószer-molekula, amely nem tartozik a szolvátburokhoz. A szolvatált részecskék – amelyeknek a mérete többszöröse mind az oldószer, mind pedig a nem szolvatált részecskék méretének – a diffúziós mozgás közben együtt mozognak a szolvátburokkal, egy mozgó egységet képeznek.
Az oldatokban az oldott anyagok a teljes térfogatban igyekeznek a teret homogénen betölteni, hasonlóan, mint ahogy a gázok a rendelkezésre álló tér egyenletes kitöltésére törekednek. Ha ezt nem akadályozza semmi, akkor ez a homogenizálódás diffúzió útján valósulhat meg. A nem homogén – tehát inhomogén, vagy heterogén – rendszerben a komponensek kémiai potenciálja a hely függvényében nem azonos, ezért önként olyan folyamatok játszódnak le, amelyek az oldatokban és a gázokban is a komponensek egyenletes eloszlásához vezethetnek (transzportjelenség).
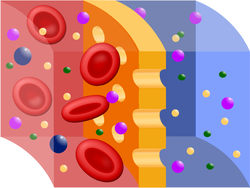
A féligáteresztő, sárga színű membránon csak a kisebb méretű részecskék juthatnak át
A részecskék mozgását akadályozza az oldatot és a tiszta oldószert (vagy hígabb oldatot) elválasztó féligáteresztő hártya, aminek következtében csak a kisebb méretű részecskék (az oldószer molekulái) képesek a féligáteresztő rétegen átjutni, a nagy átmérőjű szolvatált részecskék viszont nem. Az ilyen hártyával elválasztott oldatoknál a termodinamika miatt, a koncentrációjuk kiegyenlítése végett az oldószer részecskéi a hígabb oldatból a töményebb felé áramlanak.
Az ozmózis oka
Az ozmózis oka az, hogy kémiai potenciálkülönbség van az egymással érintkező két oldat komponensei között és az önként végbemenő kiegyenlítődés folyamán a részecskék méretviszonyai miatt a kisebb koncentrációjú oldat felől több oldószer-molekula jut időegység alatt a féligáteresztő hártyán keresztül a töményebb oldatba, mint onnét vissza a hígabb oldatba. Ennek az egyensúlyra vezető folyamatnak az eredményeként az oldott anyag kémiai potenciálja a töményebb oldatban csökken (a vízé pedig nő), a kisebb koncentrációjú oldatban pedig az oldott anyag kémiai potenciálja megnő (a vízé pedig csökken).
Az ozmózisnyomás és a fordított ozmózis

Az ozmózis következtében az oldat folyadékszintje emelkedik, a koncentrációja csökken

Az ozmózis következtében a nagyobb koncentrációjú oldat „felhígul”, térfogata megnő
Megakadályozható ez az önként végbemenő folyamat, ha az oldat felől kellően nagy nyomással az oldószer-molekulákat a féligáteresztő hártyán keresztül visszakényszerítjük a kisebb koncentrációjú oldatba. Ha a nyomás éppen akkora, hogy időegység alatt mindkét irányba ugyanannyi oldószer molekula halad át a féligáteresztő membránon, akkor kialakul egy dinamikus egyensúly. Azt a nyomást, amit ki kell fejteni, hogy ez a dinamikus egyensúly megvalósuljon, ozmózisnyomásnak nevezzük.
Ha a nyomás nagyobb, mint az egyensúlyt biztosító nyomás, akkor az oldószer ellentétes irányú áramlása alakul ki, ezt a jelenséget nevezzük fordított ozmózisnak.
Az ozmózisnyomás nagysága kiszámítható hidrosztatikai nyomás mérésével, a mellékelt ábrán látható kísérleti berendezésben. Az oldószer bejutása az oldatfázisba térfogat-növekedést okoz, ennek következményeként az edény függőleges csövében a folyadékszint fokozatosan emelkedik (ΔH). Ebből adódóan a folyadékoszlop nyomása ellene hat az oldószer beáramlásának. A folyadékszint a csőben addig emelkedik, ameddig a hidrosztatikai nyomás egyenlővé nem válik az ozmózisnyomással:
- π=ρgh .displaystyle pi =rho gh .
Az összefüggésben:
π az ozmózisnyomás, Pa
ρ az oldat sűrűsége, kg/m³
g a nehézségi gyorsulás, 9,81 m/s²
h a folyadékoszlop magassága, m
Ha a készülék zárt térben van, akkor e tér telítődik az oldószer gőzével. A gőznyomáscsökkenés törvénye alapján az oldat felett – jelen esetben a cső felső részében – az oldat gőznyomása (pA) kisebb, mint a tiszta oldószer gőznyomása (pA*). Ha a féligáteresztő hártyán keresztül beáll az ún. ozmotikus egyensúly, akkor a gőztérben is egyensúlynak kell lenni. Ehhez az szükséges, hogy a tiszta oldószerből származó gőz nyomása h magasságban ugyanakkora legyen, mint az oldatból származó oldószergőz nyomása az oldat felszínén. Az oldószer feletti gőznyomás a magasság függvényében a pA* értékről a pA-ra csökken a barometrikus nyomáscsökkenés törvényének
- pA=pA∗e−MAgh/RTdisplaystyle p_mathrm A =p_mathrm A ^*,e^-M_mathrm A gh/RT
megfelelően. Logaritmizálva a kifejezést és a fenti ozmózisnyomást behelyettesítve a
- lnpApA∗=−MAghRTdisplaystyle mathrm ln frac p_mathrm A p_mathrm A ^*=-frac M_mathrm A ghRT
kifejezést kapjuk, amiből az ozmózisnyomás:
- π=RTρMAlnpA∗pA .displaystyle pi =frac RTrho M_mathrm A mathrm ln frac p_mathrm A ^*p_mathrm A .
A kifejezésekben:
pA az oldat feletti gőznyomás, Pa
pA* a tiszta oldószer feletti gőznyomás, Pa
MA Az oldószer moláris tömege, kg/mol
R egyetemes gázállandó, 8,314 J/mol·K
T hőmérséklet, K
π ozmózis nyomás, Pa
Az ozmózisnyomásra kapott kifejezés egyszerűbb alakra hozható, ha az oldatok gőznyomására vonatkozó
- pA=xApA∗displaystyle p_A=x_mathrm A p_mathrm A ^*
Raoult-törvény alapján pA-t behelyettesítjük, és felhasználjuk a moltörtekre vonatkozó:
- xA=1−xB,valamint ln(1−xB)≈−xB displaystyle x_mathrm A =1-x_mathrm B ,mathrm valamint mathrm ln (1-x_mathrm B )approx -x_mathrm B
kifejezéseket (ha xB „elegendően kicsi”):
- π=RTρMAxB .displaystyle pi =frac RTrho M_mathrm A x_mathrm B .
A kifejezésekben:
xA az oldószer móltörtje
xB az oldott anyag móltörtje
MA az oldószer moláris tömege, kg/mol
van 't Hoff-törvény

Jacobus Henricus van 't Hoff (1852 – 1911) holland kémikus
Nem túl tömény oldatok esetén a móltört és a molaritás között fennáll a
- xB=cBMAρdisplaystyle x_mathrm B =frac c_mathrm B M_mathrm A rho
összefüggés, amit behelyettesítve az ozmózisnyomásra a következő kifejezést kapjuk:
- π=cBRT ,displaystyle pi =c_mathrm B RT ,
c molaritás, mol/m³.
A moláris koncentráció reciprokát hígításnak nevezzük. Ennek segítségével az ozmózisnyomás
- πV=RT displaystyle pi V=RT
alakban is felírható, ami nagyon hasonló a tökéletes gázokra vonatkozó általános gáztörvényhez. Bármely anyag ozmózisnyomása ugyanakkora, mint a gáz nyomása ugyanazon a hőmérsékleten, ha az oldatban rendelkezésre álló teret gáz alakban töltené ki. E törvény az ozmózisnyomásra vonatkozó van 't Hoff-törvény.
Az ozmózis gyakorlati szerepe
Az ozmózisnyomásnak fontos gyakorlati jelentősége van például az élő szervezetekben. A növényi és állati sejtek jelentős része vizes oldat, amelyet olyan féligáteresztő (szemipermeábilis) hártya vesz körül, amely a vizet átengedi, a nedvekben oldott más anyagokat nem. Vízbe helyezve a sejtet az ozmózisnyomás következtében a víz behatol a sejtbe, a sejt megduzzad, esetleg szét is szakad. Ilyen folyamat eredménye például az érett gyümölcsök széthasadása sok eső esetén. A növényi nedvek ozmózisnyomása a 20 bart is elérheti. Ez teszi lehetővé, a nedvesség – s vele együtt a tápanyag – felszívódását a magas növények csúcsáig.
Az állati és az emberi szövetek sejtjeiben az ozmózisnyomás 8 bar körüli, s a szervezet igyekszik ezt állandó értéken tartani. Az állati sejteknek rugalmas a sejtmembránjuk, de ha azokat a sejtnedvnél kisebb ozmózisnyomású (hipotóniás) oldatba helyezzük, megduzzadnak, esetleg szétpattannak. Ha viszont a környező oldat ozmózisnyomása nagyobb (hipertóniás), akkor a sejt vizet veszít és zsugorodik. A túl sós ételek azért okoznak szomjúságot, mert a szervezet vízfelvétellel igyekszik a nagy ozmózisnyomás hatását csökkenteni. Az emberi szervezet sejtjeinek oldatai a 0,9% (m/m) nátrium-klorid oldattal azonos ozmózisnyomásúak (izotóniás oldatok), ezért használnak ún. fiziológiás NaCl-oldatot injekcióhoz, infúzióhoz és a gyógyászat más területén.
Nagyon fontos a szerepe az ozmózisnak a vér tisztítása, a hemodialízis terén. A dializátor nevű szűrőben kering a vér, a szűrőben levő speciális kapillárisok külső oldalán pedig egy testhőmérsékletre felmelegített, a vérnek megfelelő összetételű speciális sóoldat, az ún. dializáló oldat, és ebbe jutnak át a két teret elválasztó membránon keresztül a vérből a salakanyagok. A sóoldat állandóan cserélődik és mindig magával viszi, kimossa a méreganyagokat.
A membrán anyaga különböző lehet, kezdetben vékony celofánt használtak, ma a sokkal jobb szintetikus membránokat (poliszulfon, poliakril-nitril stb.) részesítik előnyben. A salakanyagok a dializátor kapillárisainak membránján szűrődnek ki, melyen nagyszámú finom lyuk van. Ezeken a kisméretű lyukakon a sók, a víz és méreganyagok átjutnak, de a nagyméretű anyagok és vérsejtek nem.
Számos ipari technológia, például a víz sótalanítása, a cukorgyártás elméleti alapját jelenti az ozmózisjelenség és vele összekapcsolódva a diffúziós folyamat.
Források
Veszprémi Tamás: Általános kémia, 2. kiadás, Akadémiai Kiadó, Budapest, 2015., ISBN 978-963-05-9618-3
Kapcsolódó szócikkek
- Fordított ozmózis
- Transzportjelenség
- Diffúzió
További információk
Kategória:
- Fizikai kémia
- Biofizika
(window.RLQ=window.RLQ||[]).push(function()mw.config.set("wgPageParseReport":"limitreport":"cputime":"0.116","walltime":"0.250","ppvisitednodes":"value":374,"limit":1000000,"ppgeneratednodes":"value":0,"limit":1500000,"postexpandincludesize":"value":4991,"limit":2097152,"templateargumentsize":"value":1015,"limit":2097152,"expansiondepth":"value":9,"limit":40,"expensivefunctioncount":"value":1,"limit":500,"unstrip-depth":"value":0,"limit":20,"unstrip-size":"value":360,"limit":5000000,"entityaccesscount":"value":0,"limit":400,"timingprofile":["100.00% 66.166 1 -total"," 36.74% 24.309 1 Sablon:ISBN"," 28.59% 18.916 1 Sablon:Portál"," 14.65% 9.696 1 Sablon:Egyért2"," 14.16% 9.367 1 Sablon:Részben_nincs_forrás"," 8.33% 5.509 1 Sablon:Ambox"," 6.06% 4.008 2 Sablon:Portál/speciális"," 4.05% 2.678 1 Sablon:Commonskat"," 3.96% 2.623 1 Sablon:Portál/leírások"," 3.70% 2.451 1 Sablon:Dablink"],"scribunto":"limitreport-timeusage":"value":"0.006","limit":"10.000","limitreport-memusage":"value":587360,"limit":52428800,"cachereport":"origin":"mw1265","timestamp":"20190409202412","ttl":2592000,"transientcontent":false););"@context":"https://schema.org","@type":"Article","name":"Ozmu00f3zis","url":"https://hu.wikipedia.org/wiki/Ozm%C3%B3zis","sameAs":"http://www.wikidata.org/entity/Q54237","mainEntity":"http://www.wikidata.org/entity/Q54237","author":"@type":"Organization","name":"Contributors to Wikimedia projects","publisher":"@type":"Organization","name":"Wikimedia Foundation, Inc.","logo":"@type":"ImageObject","url":"https://www.wikimedia.org/static/images/wmf-hor-googpub.png","datePublished":"2007-05-30T20:47:36Z","dateModified":"2018-09-01T12:36:08Z","image":"https://upload.wikimedia.org/wikipedia/commons/3/3f/Hidrat%C3%A1lt_ionok.jpg"(window.RLQ=window.RLQ||[]).push(function()mw.config.set("wgBackendResponseTime":143,"wgHostname":"mw1267"););












