Osmoosi Sisällysluettelo Diffuusion mallinnus | Osmoosi biologisissa järjestelmissä | Osmoottinen mekanismi | Osmoosi energiantuotannossa | Katso myös | Lähteet | Aiheesta muualla | NavigointivalikkoparantamallaMaailman ensimmäinen osmoosivoimala starttasi NorjassaNorja rakentaa maailman ensimmäisen osmoosivoimalaitoksenOsmoottisen paineen simulointi onlineOpetus.tv: Biologian etäopiskeluympäristö, OsmoosiOsmoosi malli, flash
BiokemiaSolubiologia
diffuusiotapuoliläpäisevän kalvonvesipotentiaaliGibbsin vapaa energiapunasolutIsotonisessa liuoksessaHypotonisessaHypertonisessaplasmolyysiiinantibiootitakvaporiinifosforyloinnilladiffuusiotaNorjassaosmoosivoimalaitoksen
Osmoosi
Siirry navigaatioon
Siirry hakuun
Tätä artikkelia tai sen osaa on pyydetty parannettavaksi, koska se ei täytä Wikipedian laatuvaatimuksia. Voit auttaa Wikipediaa parantamalla artikkelia tai merkitsemällä ongelmat tarkemmin. Lisää tietoa saattaa olla keskustelusivulla. Tarkennus: artikkeliin voisi lisätä yleistajuista sisältöä. Osio "diffuusion mallinnus" on ymmärrettävä vain korkeakoulutasolla |
Osmoosi on liuottimen diffuusiota puoliläpäisevän kalvon läpi. Osmoosissa liuotin (yleensä vesi) siirtyy kalvon läpi, mutta kalvo ei päästä läpi liuottimeen liuenneita aineita. Liuotin siirtyy sille puolelle, jolla liuenneen aineen pitoisuus on suurempi. Jos esimerkiksi puoliläpäisevä kalvo erottaa suolaisen veden ja vähemmän suolaisen veden oheisen kuvan osoittamalla tavalla, vettä siirtyy makeamman veden osasta suolaisen veden osan puolelle.

Sisällysluettelo
1 Diffuusion mallinnus
2 Osmoosi biologisissa järjestelmissä
3 Osmoottinen mekanismi
4 Osmoosi energiantuotannossa
5 Katso myös
6 Lähteet
7 Aiheesta muualla
Diffuusion mallinnus |
Diffuusio-liikkeen suunta ja vauhti riippuvat
- veden konsentraatiosta kalvon eri puolilla
- painegradientista ja
- painovoimasta.
Yllä olevat tekijät yhdessä määrittävät kemiallisen potentiaaligradientin vedelle kalvon yli. Osmoosille pätee sama termodynaaminen sääntö kuin diffuusiollekin: veden liike on suuremmasta potentiaali(energia)tilasta pienempään.
Käytännössä määritellään vesipotentiaali (ψdisplaystyle psi ,!), joka saadaan jakamalla kemiallinen potentiaali (J mol-1) veden osittaisella molaarisella tilavuudella (1 mooli vettä vastaa 18×10−6displaystyle 18times 10^-6 m3 mol-1.) Vesipotentiaali on periaatteessa sama asia, kuin veden Gibbsin vapaa energia per yksikkötilavuus, ja se mitataan J m-3 (= Pa).
Formaalisesti ψ=ψs+ψp+ψgdisplaystyle psi =psi _s+psi _p+psi _g,! (ψdisplaystyle psi ,! on suhteellinen käsite. Se mitataan suhteessa puhtaaseen veteen merenpinnalla standardilämpötilassa ja paineessa) missä:
ψsdisplaystyle psi _s,! on liuenneen aineen potentiaali (katso osmoottinen paine) ja kuvaa liuenneen aineen vaikutusta veden potentiaaliin. Yleisesti jonkun aineen liukeneminen veteen vähentää veden vapaata energiaa laimentamalla sitä (entropia kasvaa koska liuenneet molekyylit kasvattavat järjestelmän epäjärjestäytyneisyyttä). Puhtaan veden konsentraatio on n. 56 mol dm-3. Liuottamalla aineita veteen vähentää siis ψsdisplaystyle psi _s,!, tehden siitä negatiivisen verrattuna pelkän veden arvoon ψs=0displaystyle psi _s=0,!. Laimeille liuoksille ψsdisplaystyle psi _s,! vedessä hajoamattomille yhdisteille (kuten glukoosi) noudattaa van't Hoffin yhtälöä:
- ψs=−RTcsdisplaystyle psi _s=-RTc_s,!
- missä cs on liuenneen aineen konsentraatio (mol dm-3), R kaasuvakio ja T absoluuttinen lämpötila. Jos kyseessä on hajoava aine, yhtälön oikea puoli kerrotaan hajoamisesta seuraavien hiukkasten määrällä (kerroin olisi esimerkiksi 2 NaCl:lle).
ψpdisplaystyle psi _p,! on painepotentiaali, joka kuvaa (positiivisen tai negatiivisen) paineen vaikutusta veden potentiaaliin. Tällä on yleensä merkitystä vasta 5 metrissä (ja sitä korkeammalla). Negatiivinen paine vähentää veden potentiaalia (vähemmän energiaa, potentiaali pienenee), ja positiivinen paine kasvattaa sitä (enemmän energiaa, potentiaali kasvaa). Paine mitataan suhteessa merenpintaan. Tämä komponentti on tärkeä soluseinällisissä soluissa. Protoplasti puskee periksiantamatonta soluseinää vasten ja Newtonin kolmannen lain mukaan seinä puskee takaisin samalla voimalla. Tämä johtaa siihen, että esimerkiksi kasvit eivät nuupahda kasaan.
ψgdisplaystyle psi _g,! on painovoiman vaikutukset sisällyttävä termi.
Osmoosi on siis veden liikettä suuremmasta vesipotentiaalista ψ1displaystyle psi _1,! pienempään potentiaaliin ψ2displaystyle psi _2,! (ψ1>ψ2displaystyle psi _1>psi _2,!) puoliläpäisevän kalvon ylitse.
Osmoosi biologisissa järjestelmissä |
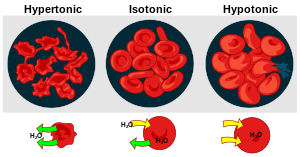
Punasoluja hypertonisessa, isotonisessa ja hypotonisessa liuoksessa.
Soluseinättömissä soluissa solukalvon ylitse ei ole merkittävää paine- tai painovoimaeroa. Vesipotentiaaliero riippuu siis pelkästään ψsdisplaystyle psi _s,!:stä, joka puolestaan riippuu liuenneiden aineiden konsentraatioista. Esimerkiksi punasolut ovat herkkiä osmoottiselle veden liikkeelle. Isotonisessa liuoksessa solun ulkopuolinen konsentraatio vastaa solun sisäistä, jolloin punasolut ovat normaalissa kaarevassa muodossaan (kts. kuva).
Hypotonisessa liuoksessa solun sisällä on suurempi konsentraatio (ψs1<ψs2displaystyle psi _s1<psi _s2,!, missä ψs1displaystyle psi _s1,! on solunsisäinen ja ψs2displaystyle psi _s2,! solun ulkopuolinen), jolloin ψ1<ψ2displaystyle psi _1<psi _2,! (eli solun sisällä on negatiivisempi ψdisplaystyle psi ,!, kuin sen ulkopuolella) ja vesi syöksyy soluun. Tämä johtaa solun pullistumiseen, joka voi johtaa jopa solun kokonaisvaltaiseen repeytymiseen. Tullessaan soluun vesi tasapainottaa konsentraatioeroja, ja solun paisuminen jatkuu, kunnes potentiaalit ovat yhtäsuuruiset. Hypertonisessa liuoksessa tilanne on päinvastainen ja vesi pakenee solusta. Välttääkseen mahdollisesti vahingolliset veden liikkeet, solut aktiivisesti pumppaavat ioneja solukalvon ylitse (mm. Na+, K+ ja Cl-) säädelläkseen konsentraatioeroja.
Soluseinällisissä soluissa hypotonisessa liuoksessa soluseinä vastustaa laajenemista johtaen paineeseen. Tämä johtaa ψpdisplaystyle psi _p,! kasvuun, joka kasvaa, kunnes solunsisäinen ψdisplaystyle psi ,! on sama, kuin solun ulkopuolinen. Hypertonisessa liuoksessa tilanne on päinvastainen: vesi poistuu solusta, kunnes ψp=0displaystyle psi _p=0,!. Vesi jatkaa poistumistaan, kunnes solun tilavuus on pienentynyt tarpeeksi, jotta ψsdisplaystyle psi _s,! on tasapainottanut solunsisäisen ψdisplaystyle psi ,!:n vastaamaan solunulkopuolista. Tämä johtaa usein solukalvon kuoriutumiseen pois soluseinältä, eli plasmolyysiiin. Myös soluseinälliset solut pumppaavat ioneja (pääasiassa H+) estääkseen radikaalit veden liikkeestä johtuvat muutokset.
Soluseinällisen solun kasvu vaatii myös soluseinän rakenteen löysentämistä. Solu laskee sisäistä ψdisplaystyle psi ,! laskemalla ψsdisplaystyle psi _s,!:tä pumppaamalla sisään veteen liuenneita aineita. Tämä johtaa veden sisääntuloon, ja sitä kautta ψpdisplaystyle psi _p,!:n kasvuun (paineen kasvuun), joka työntää soluseinän uuteen laajempaan muotoon. Jotkut antibiootit heikentävät bakteereiden soluseiniä, pienentäen niiden kykyä sietää sisäistä painetta johtaen bakteerisolujen hajoamiseen.
Osmoottinen mekanismi |
Vesi pystyy ylittämään solukalvot ilman huomattavia ongelmia huolimatta veden pienestä rasvojen läpäisykyvystä. Solukalvoilla onkin niin kutsuttuja akvaporiini-proteiineja (engl. aquaporins), joiden rakenteessa on n. 400 nm suuruinen reikä, joka mahdollistaa veden liikkeen. Solu reguloi akvaporiineja fosforyloinnilla ja solunsisäisellä Ca2+:n konsentraatiolla. Nykytietämyksen mukaan osmoosi on yhdistelmä yksittäisten vesimolekyylien diffuusiota solukalvon lävitse, sekä suurten määrien liikettä avointen akvaporiinien läpi.
Osmoosi energiantuotannossa |
Statkraft Norjassa on rakentanut maailman ensimmäisen pilottiluonteisen osmoosivoimalaitoksen, jonka toiminta alkoi 24. marraskuuta 2009.[1] Ensimmäinen täysikokoinen kaupallinen laitos voisi olla toiminnassa vuonna 2015. Osmoosivoimalaitos käyttää meriveden ja makean jokiveden välistä painetta uusiutuvana energianlähteenään.[2][3]
Katso myös |
- Diffuusio
- Osmoottinen paine
- Transpiraatio
- Juuripaine
- Haihtumisimu
- Kapillaari-ilmiö
- Käänteisosmoosi
Lähteet |
↑ Maailman ensimmäinen osmoosivoimala starttasi Norjassa Tietokone.fi 27.11.2009.
↑ Norja rakentaa maailman ensimmäisen osmoosivoimalaitoksen YLE 3.10.2007
↑ Osmoottisen paineen simulointi online
Aiheesta muualla |
- Opetus.tv: Biologian etäopiskeluympäristö, Osmoosi
- Osmoosi malli, flash
Luokat:
- Biokemia
- Solubiologia
(window.RLQ=window.RLQ||[]).push(function()mw.config.set("wgPageParseReport":"limitreport":"cputime":"0.100","walltime":"0.290","ppvisitednodes":"value":344,"limit":1000000,"ppgeneratednodes":"value":0,"limit":1500000,"postexpandincludesize":"value":2165,"limit":2097152,"templateargumentsize":"value":818,"limit":2097152,"expansiondepth":"value":8,"limit":40,"expensivefunctioncount":"value":0,"limit":500,"unstrip-depth":"value":0,"limit":20,"unstrip-size":"value":2202,"limit":5000000,"entityaccesscount":"value":0,"limit":400,"timingprofile":["100.00% 41.240 1 -total"," 35.76% 14.748 1 Malline:Korjattava"," 26.42% 10.895 1 Malline:Viestipohja"," 16.50% 6.803 2 Malline:Nimiavaruus"," 16.07% 6.629 1 Malline:Viitteet"],"cachereport":"origin":"mw1330","timestamp":"20190409180119","ttl":2592000,"transientcontent":false););"@context":"https://schema.org","@type":"Article","name":"Osmoosi","url":"https://fi.wikipedia.org/wiki/Osmoosi","sameAs":"http://www.wikidata.org/entity/Q54237","mainEntity":"http://www.wikidata.org/entity/Q54237","author":"@type":"Organization","name":"Contributors to Wikimedia projects","publisher":"@type":"Organization","name":"Wikimedia Foundation, Inc.","logo":"@type":"ImageObject","url":"https://www.wikimedia.org/static/images/wmf-hor-googpub.png","datePublished":"2005-03-23T11:23:08Z","dateModified":"2017-01-01T20:27:45Z","image":"https://upload.wikimedia.org/wikipedia/commons/6/63/Osmose.svg"(window.RLQ=window.RLQ||[]).push(function()mw.config.set("wgBackendResponseTime":138,"wgHostname":"mw1275"););















